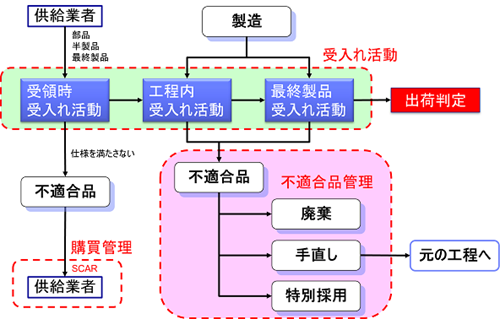
不適合品管理
不適合品管理
今回は医療機器製造における不適合品管理について考察してみたい。
まず、不適合と不適合品は異なるので注意が必要である。
- 不適合(Nonconformity)とは、規定要求事項を満たしていないことをいう。
- 不適合品(Nonconformity Product)とは、指定要求事項(仕様)を満たしていない製品のこと。
ISO 13485の「8.3 不適合製品の管理」では、「8.3.2 引き渡し前の不適合製品における処置」と「8.3.3 引き渡し後に発見された不適合製品における処置」に区分されている。
今回は、前者の「8.3 不適合製品の管理」について解説する。
8.3.2 引き渡し前の不適合製品における処置
組織は、次の一つまたは複数の方法で、不適合製品を処理する。
a) 発見された不適合を除去するための処置をとる。
b) 本来の意図された使用または適用ができないような処置をとる。
c) 特別採用によって、その使用、リリースまたは合格と判定することを正式に許可する。
組織は、正当性が提供され、承認が得られ、適用される規制要求事項が満たされる場合に限って、特別採用によって不適合製品を受け入れることを確実にする。
特別採用による受け入れおよび特別採用を許可した人を識別する記録は、維持する(4.2.5参照)。
引き渡し前、つまり製造中に発生した不適合製品では、以下の3つのうちどれか1つの処置を採らなければならない。
- 発見された不適合を除去するための処置をとる。(リワーク)
- 本来の意図された使用または適用ができないような処置をとる。(廃棄)
- 特別採用によって、その使用、リリースまたは合格と判定することを正式に許可する。(特別採用)
リワーク(手直し)
製造工程内で不適合製品を発見した場合、リワークつまり製造し直しをすることがある。
ISO 13485の「8.3.4 手直し」には以下の要求がある。
8.3.4 手直し
手直しは、その手直しが製品に与える潜在的悪影響を考慮して文書化された手順に従い手直しを実施する。
この手順は、元の手順と同様のレビュおよび承認に基づいて発行される。
手直しの完了後、製品が、適用される受け入れの基準および規制要求事項に適合していることを確実にするために、製品を検証する。
手直しの記録は、維持する(4.2.5参照)。
筆者が医療機器企業を監査する中で、手順書を作成せずリワークを実施している企業をしばしば見かける。
これは規制要件違反である。
リワークのための手順書は、不適合製品毎に作成しなければならず、「取り外し手順」「再組み立て手順」「追加の検査手順」等を含めなければならない。
つまり、手順書もなしに取り外してはならないのである。
また一旦組付けた部品等を取り外し、再組み立てをする訳であるから、機器にダメージを与えている可能性がある。したがって、通常の検査に加えて必要な検査手順を実施しなければならない。
当該手順は、製造手順書を作成したのと同様の者がレビュ、承認して発行しなければならない。
廃棄
例えば、購買した部品等の受領検査で不適合になった場合、ラインに入れてはならず、廃棄するかまたは当該供給業者に返却することとなる。
また、機器によっては、最終検査で不適合となった場合は、リワークではなく廃棄する場合もあるだろう。
特別採用
医療機器において、特別採用が適用できるケースは、顧客が合意している(顧客要求を満たしている)ことおよび規制要件を満たしている場合に限られる。
筆者がコンサルテーションや監査を実施する中で、特別採用を繰り返しているケースを見かけることがある。
同じ問題により特別採用を繰り返すことは認められない。(ただし、規制要件等には特別採用を繰り返してはならないとは明記されていない。)
常識的に考えて特別採用を繰り返すということは、
設計基準を蔑ろにしている。
製造工程を改善できていない。
のいずれかまたは両方ということになるためである。
2度と特別採用を実施しなくて良いようにするためには、
設計基準を緩める
CAPAを実施し再発防止に努める
のいずれかの方策をとらなければならないのである。 一般に、顧客の要求基準よりも設計基準が狭く、設計基準よりも製造基準が狭くなければならない。