
合理的に予見可能な誤使用とは何か
医療機器や産業機器の設計において、「合理的に予見可能な誤使用」という概念は、製品の安全性を確保する上で極めて重要である。製造業者は、使用者が必ずしも取扱説明書通りに製品を使用するとは限らないという前提に立ち、起こりうる誤使用を想定した設計を行わなければならない。本稿では、この概念の定義と実践的な考え方について、国際規格や規制要求に基づいて解説する。
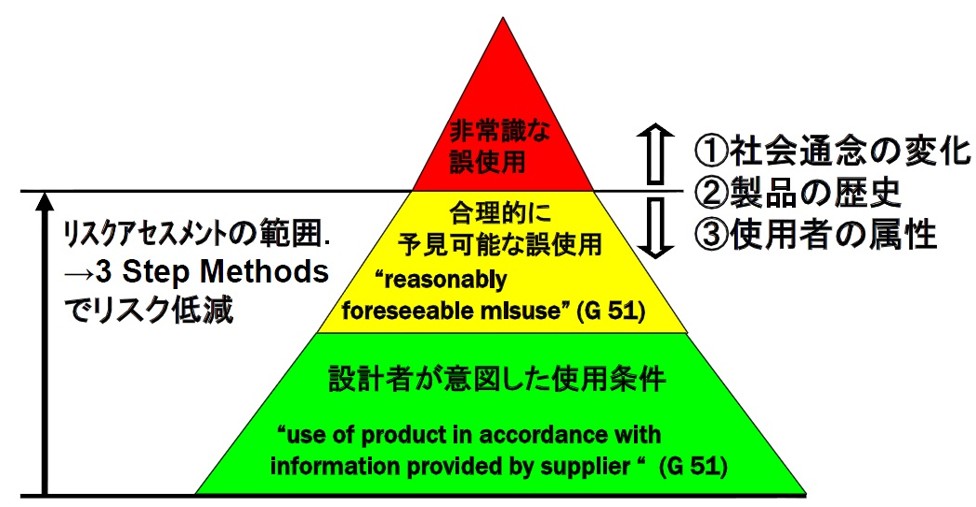
国際規格における定義
合理的に予見可能な誤使用(reasonably foreseeable misuse)とは、ISO 14971:2019(医療機器のリスクマネジメント規格)の3.15項で明確に定義されている概念である。これは、製造業者が意図しない使用方法のうち、人間の行動特性から容易に予測可能な使用方法を指す。
重要なのは、この概念が単なる理論ではなく、世界各国の規制当局が製品安全性評価の必須要件としている点である。
誤使用に含まれる要素
ISO 14971およびIEC 62366(医療機器のユーザビリティエンジニアリング規格)では、以下の要素を誤使用リスクの主要因として挙げている。
- ヒューマンエラー:注意力の欠如、記憶違い、判断ミスなど
- 使用環境の制約:照明、騒音、時間的プレッシャーなど
- 使用者の属性:年齢、能力、経験、文化的背景など
- 日常的な行動パターン:慣れによる省略、思い込みなど
誤使用の分類と具体例
1. 操作ミスによる誤使用
最も一般的な誤使用は、単純な操作ミスである。実際のリスクアセスメントで頻繁に取り上げられる例として
輸液ポンプの流量設定ミス
- 意図:10.0 mL/h
- 誤入力:100 mL/h(小数点の入力忘れ)
- 結果:10倍の薬剤が投与される危険性
このような桁違いの入力ミスは、FDAのヒューマンファクターズ・ガイダンスでも重点的に対策すべき事項として挙げられている。
2. 使用者の属性に起因する誤使用
IEC 62366では、使用者の多様性を考慮することが強調されている。
高齢者の場合
- 小さな文字や低コントラストの表示が読みにくい
- 複雑な操作手順を覚えにくい
- 細かな手の動きが困難
色覚特性を持つ使用者の場合
- 赤と緑の警告灯の区別が困難
- カラーコードのみに依存した情報伝達の問題
子供がアクセス可能な環境の場合
- すべてのボタンを押してみる探索行動
- 見た目が面白いものに触りたがる特性
3. 使用環境による誤使用
医療現場のような高ストレス環境では、通常では考えにくい誤使用が発生する。
救急医療現場での例
- 患者の急変時、慌てて誤った機器の電源を切断
- 複数の警報音が鳴る中での、重要アラームの聞き逃し
- 暗い環境下での、類似した形状のコネクタの誤接続
リスクマネジメントにおける実践的アプローチ
1. 設計による本質的安全確保(最優先事項)
ISO 12100やISO 14971で示される安全設計の原則では、設計による本質的な安全確保が最優先とされている。具体的な手法
エラープルーフ設計
- 物理的に誤接続できない形状のコネクタ
- 危険な設定値を入力できないソフトウェア制限
- 重要な操作には必ず確認ステップを設ける
フェイルセーフ機能
- 異常値検出時の自動停止機能
- デフォルト設定を最も安全な状態にする
- 電源喪失時の安全な停止モード
2. ユーザビリティエンジニアリングの体系的適用
IEC 62366に基づいたユーザビリティエンジニアリングプロセス
-
使用者プロファイルの明確化
・想定使用者の能力、知識、経験を詳細に分析 -
使用環境の特定
・実際の使用場所の照明、騒音、作業負荷を評価 -
タスク分析
・使用者が行う全ての操作を分解し、エラーポイントを特定 -
形成的評価
・開発段階で実際の使用者による評価を繰り返し実施 -
総括的評価
・最終製品で誤使用リスクが許容レベルまで低減されたことを検証
3. 補助的手段としての警告・トレーニング
設計対策で除去できないリスクに対してのみ、以下の補助的手段を適用
- 警告表示:ISO 3864に準拠した視認性の高い警告
- 使用者トレーニング:定期的な再教育プログラムの提供
- 取扱説明書:想定される誤使用とその回避方法の明記
ただし、これらは設計による対策の代替手段ではないことに注意が必要である。
非常識な誤使用との境界
判断基準の明確化
合理的に予見可能な誤使用と、予見不可能な非常識な使用との境界は、以下の要素を総合的に判断
-
類似製品での事故事例データベース
・FDA MAUDE、厚労省の医療機器不具合報告など -
使用者調査の結果
・実際の使用者の行動観察データ -
社会的・文化的要因
・地域による使用習慣の違い
・技術リテラシーの差 -
リスク・ベネフィット分析
・対策コストと被害の重大性のバランス
境界の変化への対応
「電子レンジで猫を乾かす」の例のように、かつて非常識とされた行為も、事故の発生により予見可能な誤使用として扱われるようになることがある。製造業者は市販後監視を通じて、新たな誤使用パターンを継続的に把握する必要がある。
規制要求事項との関係
主要な規制要求
各国・地域の規制当局は、合理的に予見可能な誤使用への対応を明確に要求している。
米国FDA
- ヒューマンファクターズ・エンジニアリングの適用を義務化
- 510(k)申請時にユーザビリティ評価報告書の提出が必要
- 実使用環境でのバリデーション試験を要求
欧州MDR(Medical Device Regulation)
- Annex I, Chapter I, 5項でユーザビリティ要求事項を規定
- 使用者の特性、使用環境を考慮したリスク低減を要求
- 臨床評価にユーザビリティ側面を含めることを要求
日本PMDA
- 基本要件基準でヒューマンファクターを考慮した設計を要求
- 承認申請時に誤使用リスクの評価と対策の説明が必要
規制対応の実務
これらの規制要求を満たすためには
-
開発初期からの統合的アプローチ
・設計開発計画にユーザビリティ活動を組み込む
・段階的なリスク評価とフィードバック -
文書化の徹底
・ユーザビリティエンジニアリングファイルの作成
・トレーサビリティの確保 -
市販後監視との連携
・実使用でのインシデント情報の収集
・継続的な改善活動
実践的な導入ステップ
組織での実装方法
-
体制構築
・ユーザビリティ専門家の育成・採用
・部門横断的なチームの形成 -
プロセスの確立
・既存の設計開発プロセスへの統合
・チェックリストとレビュー基準の策定 -
ツールの整備
・ユーザビリティ試験設備の確保
・データ収集・分析システムの構築 -
継続的改善
・定期的な有効性評価
・ベストプラクティスの共有
まとめ
合理的に予見可能な誤使用への対応は、単なる規制要求の充足ではなく、製品の本質的な安全性を確保するための重要な活動である。「使用者を責めるのではなく、誤使用が起きにくい設計を追求する」という現代の安全設計思想は、すべての製造業者が持つべき基本姿勢である。
技術の進歩とともに製品は複雑化し、新たな誤使用のパターンも生まれている。しかし、ISO 14971、IEC 62366、各国規制が示す体系的なアプローチを適切に適用することで、これらのリスクは管理可能である。
重要なのは、合理的に予見可能な誤使用を「想定外」として扱うのではなく、「当然起こりうること」として設計段階から考慮することである。この考え方が、真に安全で使いやすい製品を生み出す基盤となるのである。
関連商品








