GAMPとは何か
GAMPとは何か – サプライヤー向けガイダンスの誕生秘話
製薬業界において、コンピュータシステムの品質保証は患者の安全性に直結する重要な要素である。そのコンピュータバリデーションの世界標準として知られるGAMP(Good Automated Manufacturing Practice)は、実は製薬企業向けではなく、サプライヤー向けのガイダンスとして誕生した。本稿では、GAMPの誕生秘話とその特徴について、具体的なエピソードを交えながら解説する。
1991年、英国での誕生 – FDA査察が引き金に
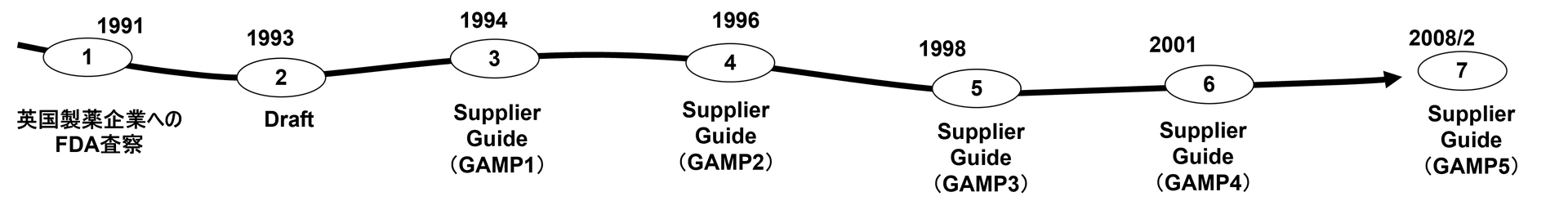
GAMPの歴史は1991年の英国に遡る。きっかけは、英国の大手製薬企業であるグラクソ社(現GSK)とICI社(現アストラゼネカ)が受けたFDA(米国食品医薬品局)の査察であった。
両社は査察において、コンピュータシステムに関して「医薬品レベルの品質管理が不足している」という厳しい指摘を受けた。当時、製薬業界では製造設備や品質管理システムのコンピュータ化が急速に進展していたが、これらのシステムを提供するサプライヤーの多くは、製薬業界特有の厳格な規制要件について十分な理解を持っていなかった。
つまり、製薬企業は高品質なシステムを求めていたが、サプライヤーは一般的な産業用システムの基準で開発・提供していたのである。このギャップが、FDA査察での指摘事項として表面化したのだ。

GLAXOはもともと幼児用の粉ミルクの登録商標
サプライヤー教育という画期的な発想
この問題に直面した英国の製薬業界は、従来とは異なる画期的なアプローチを選択した。それは「サプライヤーを教育する」という発想である。
従来のアプローチでは、各製薬企業が個別にサプライヤーに要求事項を説明し、規制要件への対応を求めていた。しかし、これでは非効率であり、サプライヤーも各社の異なる要求に混乱してしまう。
そこで英国の製薬業界は、業界共通のガイダンスを作成し、サプライヤーに医薬品レベルの品質管理を理解してもらうという方針を打ち出した。この発想から生まれたのがGAMPである。
1994年ロンドン会議 – 国際的な広がりの始まり
GAMPの重要な転機となったのが、1994年にロンドンで開催された最初の国際会議である。この会議では、サプライヤー向けガイダンスの草案が発表された。
会議には英国だけでなく、欧州各国や米国からも製薬企業とサプライヤーが参加した。参加者たちは、このガイダンスが単に英国の問題解決策ではなく、世界中の製薬業界が直面している共通の課題への解決策であることを認識した。
なぜサプライヤー向けだったのか – 3つの理由
GAMPがサプライヤー向けに作成された理由は、具体的に以下の3つに集約される。
第一に、効率性の観点である。 例えば、10社の製薬企業がそれぞれ5社のサプライヤーと取引している場合、個別教育では50回の教育が必要となる。しかし、共通ガイダンスであれば、5社のサプライヤーが一度学習すれば済む。
第二に、品質の均一化である。 サプライヤーが最初から規制要件を理解していれば、「なぜこの文書が必要なのか」「なぜこのテストを実施するのか」という根本的な理解のもとで開発が行われ、形式的ではない実質的な品質保証が実現する。
第三に、査察対応の改善である。 FDA査察では、システムの設計根拠や検証記録の提示が求められる。サプライヤーが規制要件を理解していれば、これらの文書も適切に作成され、製薬企業が後から作り直す必要がなくなる。
GAMPの基本理念の進化
GAMPの基本理念は、時代とともに進化してきた。
初期のGAMP(1991-2007年) 当初のGAMPは、主にライフサイクルアプローチに重点を置いていた。システムの構想段階から廃棄まで、各段階で必要な活動を明確に定義することで、サプライヤーに「いつ、何をすべきか」を示した。
GAMP 5以降(2008年-現在) 2008年に発行されたGAMP 5では、リスクベースアプローチが明確に導入された。すべてのシステムに同じレベルの検証を求めるのではなく、患者への影響度に応じて適切なレベルの品質保証活動を行うという考え方である。
例えば、直接患者の治療に使用される医療機器のソフトウェアと、在庫管理システムでは、求められる検証のレベルが異なる。この違いを明確にすることで、効率的かつ効果的な品質保証が可能となった。
国際標準への発展 – GAMP Forumの役割
1994年のロンドン会議を機に設立されたGAMP Forumは、GAMPの国際的な普及に重要な役割を果たした。GAMP Forumは以下の活動を通じて、GAMPを世界標準へと押し上げた。
1.ガイダンスの定期的な改訂
- 技術の進歩や規制の変化に対応
- 2022年にはGAMP 5第2版を発行
2.教育活動の展開
- 世界各地でのセミナーやワークショップ
- サプライヤー向けトレーニングプログラム
3.規制当局との対話
- FDA、EMA(欧州医薬品庁)、日本の厚生労働省などとの協議
- 規制ガイダンスへのGAMP原則の反映
GAMPがもたらした具体的な変革
GAMPの登場は、製薬業界に以下のような具体的な変革をもたらした。
サプライヤーの変化
- 製薬業界専門のシステム開発部門の設置
- 品質保証担当者の配置
- 規制要件に対応した標準製品の開発
製薬企業とサプライヤーの関係
- 「発注者と受注者」から「パートナー」への変化
- 共同でのリスクアセスメントの実施
- 長期的な協力関係の構築
業界全体の効率化
- バリデーション文書のテンプレート化
- ベストプラクティスの共有
- 査察準備期間の短縮
現在のGAMPとその意義 – デジタル時代への対応
2024年現在、GAMPは新たな技術課題に対応し続けている。GAMP 5第2版(2022年)では、以下のような最新技術に関するガイダンスが追加された。
- クラウドコンピューティング:データの所在地、セキュリティ、可用性の考慮
- 人工知能・機械学習:アルゴリズムの検証方法、継続的学習への対応
- ブロックチェーン:データの完全性、監査証跡の新しい形
- アジャイル開発:従来のウォーターフォール型からの移行
これらの新技術においても、「サプライヤーとの協働」というGAMPの基本精神は変わらない。むしろ、技術が複雑化するほど、この協働の重要性は増している。
おわりに – 教訓と未来への示唆
GAMPの誕生秘話は、規制対応を単なる負担と捉えるのではなく、品質向上の機会として捉え、業界全体で取り組むことの重要性を教えてくれる。
グラクソ社とICI社がFDA査察で受けた指摘は、当時の関係者にとっては厳しいものだったに違いない。しかし、その経験を個社の問題として終わらせず、業界全体の課題として捉え、サプライヤー教育という革新的な解決策を生み出したことが、今日のGAMPの成功につながっている。
製薬業界のデジタル化は今後さらに加速する。IoT、ビッグデータ、量子コンピューティングなど、新しい技術が次々と登場している。これらの技術を患者の利益のために安全かつ効果的に活用するためには、30年以上前に英国で生まれた「サプライヤーとの協働」という精神が、今後も重要な指針となるであろう。
GAMPの物語は、危機を機会に変え、競合他社とも協力して業界全体の発展を目指すという、製薬業界の優れた文化を象徴している。この精神こそが、次の30年も製薬業界の品質保証を支える基盤となるはずである。







