PIPスキャンダルからMDRへ
PIPスキャンダルからMDRへ
1. スキャンダルの発端:PIP社の致命的決断
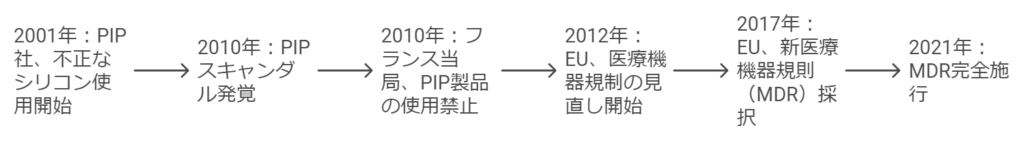
2001年、フランスの小さな町ラ・セーヌ=シュル=メールに本社を置く医療機器メーカー、Poly Implant Prothese(PIP)社は、後に世界中の女性たちの人生を脅かす大規模なスキャンダルの発端となる決定を下した。コスト削減のため、医療用シリコンの代わりに工業用シリコンを使用し始めたのである。この決定は、短期的な利益を追求するあまり、患者の安全を軽視するという致命的な過ちであった。
2. 問題の発覚:異常な破裂率と販売禁止
数年が経過し、2009年になると、フランスの外科医たちがPIP社製のインプラントの破裂率が異常に高いことに気づき始めた。患者たちの体内で、インプラントが破裂し、有害な物質が漏れ出す事例が相次いだ。この懸念は瞬く間に広がり、2010年3月、フランス保健製品衛生安全庁(AFSSAPS)がPIP社製インプラントの販売と使用を禁止するに至った。
3. グローバルな影響:世界中に広がる恐怖
この決定は、世界中に衝撃を与えた。推定30万個以上のインプラントが、既に世界65カ国で使用されていたからだ。ニュースは瞬く間に広がり、世界中の女性たちを恐怖に陥れた。自分の体内にあるインプラントが安全なのか、健康被害はないのか、多くの女性たちが不安に苛まれた。さらに、16万人以上の被害者が特定できないという新たな問題も浮上し、事態の深刻さを一層際立たせた。
4. 規制当局の対応:MDRの策定へ
欧州の規制当局は、この事態を重く受け止めた。既存の医療機器規制の欠陥が明らかになり、より厳格な規制の必要性が叫ばれた。欧州委員会は、新たな規制フレームワークの策定に着手し、数年にわたる議論と準備を経て、2017年、欧州連合(EU)は医療機器規則(MDR)を採択した。
5. MDRの特徴:革新的な安全対策
MDRは、PIPスキャンダルの教訓を活かし、革新的な要素を多く含んでいた。厳格な市販後監視システム、医療機器の分類システムの見直し、臨床評価とリスク管理の強化、そしてUDI(Unique Device Identification)システムの導入などが、その代表的な例である。これらの措置は、患者の安全を最優先し、医療機器の追跡を容易にすることを目的としていた。
6. 新時代の幕開け:MDRの完全施行
2021年5月26日、MDRが完全施行された。この日は、欧州の医療機器業界にとって新時代の幕開けとなった。PIPスキャンダルという悲劇から生まれたMDRは、患者の安全と医療機器の品質向上を約束する希望の光となったのである。
7. 継続する課題と教訓
しかし、この物語はまだ終わっていない。PIPスキャンダルとMDRの制定は、医療機器業界に深い教訓を残した。患者の安全を最優先すること、厳格な品質管理の重要性、そして規制当局の役割の重要性である。一方で、未だに特定されていない多くの被害者の存在は、この問題が完全には解決していないことを私たちに思い出させる。
8. 未来への展望:安全性と信頼の追求
日本を含む世界の医療機器業界は、この教訓を胸に刻み、より安全で信頼できる製品の開発に邁進している。PIPスキャンダルという暗い過去から生まれたMDRは、より明るい医療の未来への道を照らし出している。この規制は、単なる法令の枠を超え、患者の安全と信頼を守る砦として、今後も進化し続けていくだろう。