FDAの組織と査察
アメリカ食品医薬品局(FDA)は、アメリカ合衆国保健福祉省の下部組織として位置づけられ、食品や医薬品などの規制を担う連邦政府機関である。2024年10月の組織改編により、その組織構造は大きく刷新された。以下、FDAの最新の組織構造と査察体制について詳述する。
1. FDAの本部と所在地
FDAの本部は、メリーランド州シルバースプリングのWhite Oak Federal Research Centerキャンパス内に位置している。この施設は最新の研究設備と事務機能を備えた複合施設となっており、連邦政府の中枢機能との緊密な連携を可能にしている。ワシントンD.C.特別区に近接しているため、一般的には「FDAはワシントンにある」と表現されることが多いが、正確な所在地はメリーランド州である。
2. FDAの主要センター構成
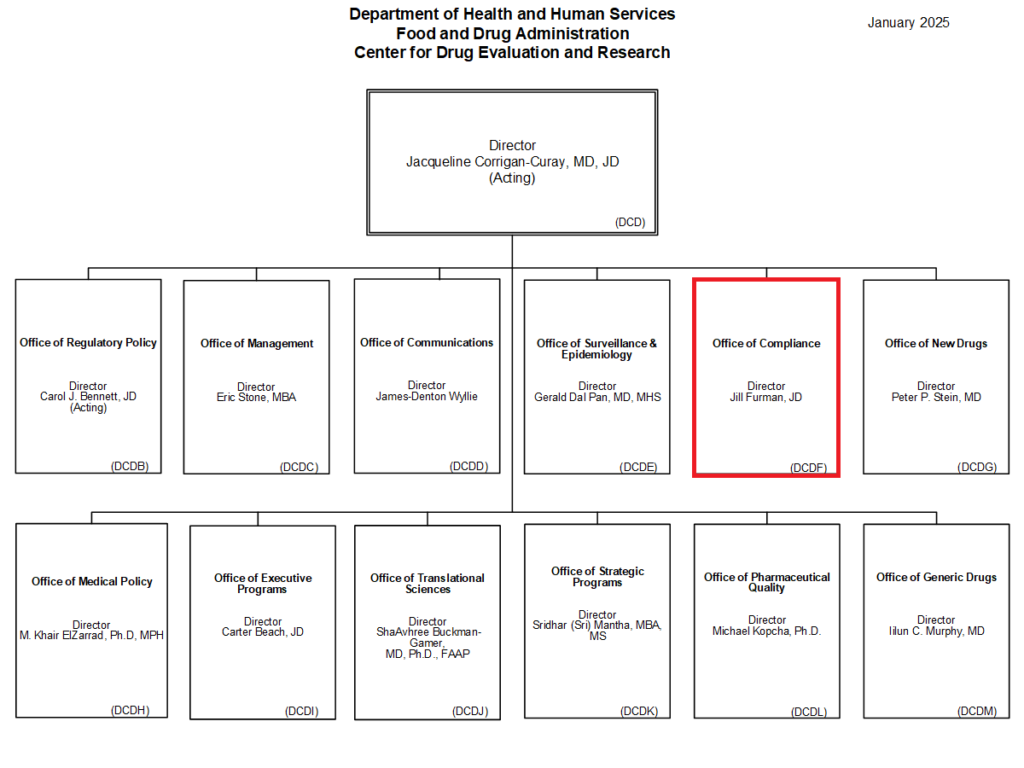
2024年10月の組織改編により、FDAは現在9つの主要センターから構成されている。各センターは特定の製品分野における規制と監督を担当している。
- 人用医薬品の評価と規制を担当するCenter for Drug Evaluation and Research(CDER)は、8部門体制で運営されており、新薬審査部門、ジェネリック医薬品部門、戦略プログラム部門などを擁している。処方箋医薬品、一般用医薬品、ジェネリック医薬品の安全性と有効性を評価し、市販後調査も実施している。
- Center for Biologics Evaluation and Research(CBER)は、生物製剤の評価と研究を担当している。ワクチン、血液製剤、アレルギー製剤、細胞・組織製品、遺伝子治療製品などの生物学的製剤を管轄している。特に、新興の生物学的製剤に関する規制枠組みの構築においても重要な役割を担っている。
- Center for Devices and Radiological Health(CDRH)は、医療機器と放射線機器の規制を担当している。単純な医療用具から高度な電子医療機器まで、幅広い医療機器の安全性と有効性を評価している。また、放射線を放出する機器の規制も行っている。
- 食品安全部門は、組織改編によりHuman Foods Programに統合された。これにより、従来のCenter for Food Safety and Applied Nutrition(CFSAN)の機能は、より包括的な食品安全管理体制の中に組み込まれている。
- Center for Tobacco Products(CTP)は、2009年のFamily Smoking Prevention and Tobacco Control Actの制定により設立された。タバコ製品の製造、販売、流通に関する規制を担当し、特に未成年者の喫煙防止に重点を置いている。
- その他、Center for Veterinary Medicine(CVM)、National Center for Toxicological Research(NCTR)、Oncology Center of Excellence(OCE)、Office of Operationsが、それぞれの専門分野で重要な役割を果たしている。
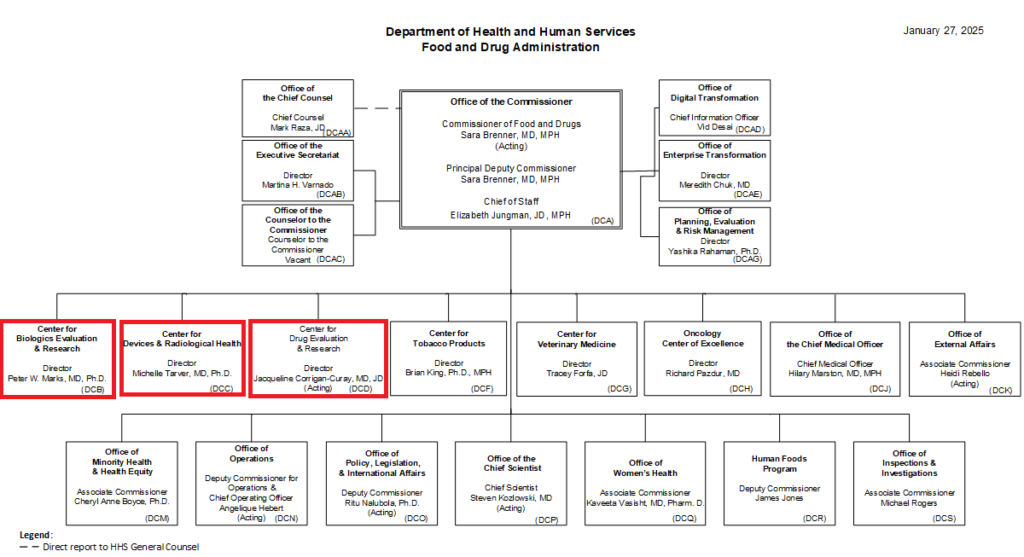
3. Office of Inspections and Investigations (OII)の役割と機能
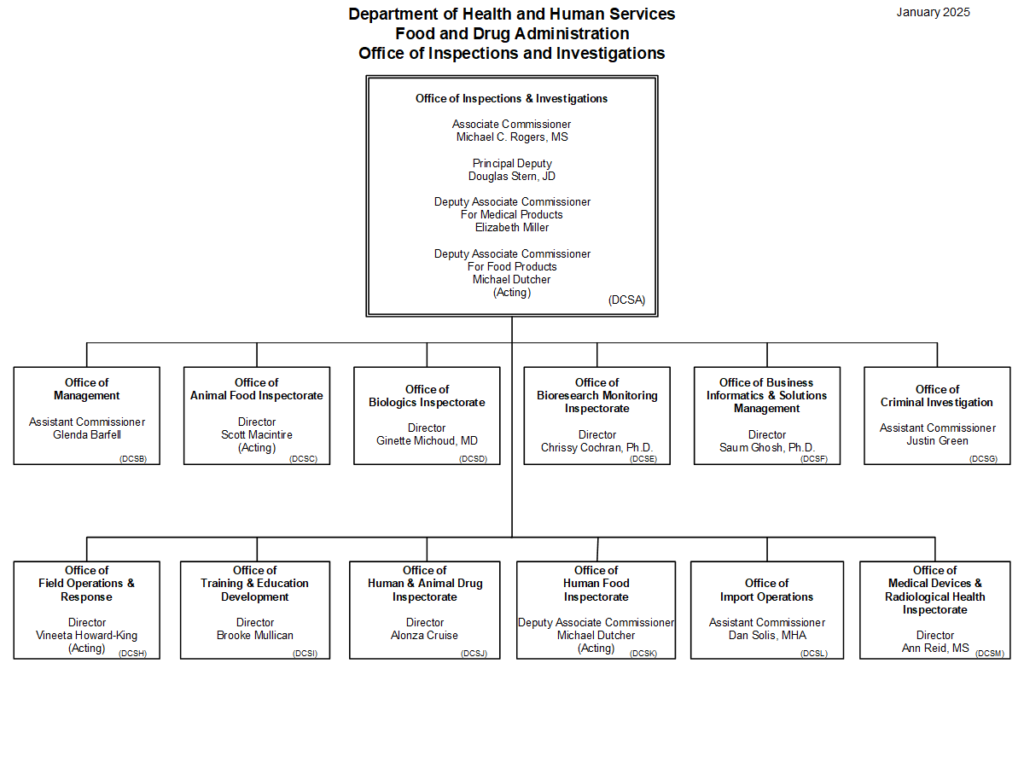
2024年10月の組織改編により、従来のOffice of Regulatory Affairs(ORA)はOffice of Inspections and Investigations(OII)に再編された。OIIは査察・輸入・緊急対応を一元的に統括する組織として機能している。
OIIは全米29か所に地方事務所を設置し、各地域での規制執行を担っている。これらの地方事務所は、日本の都道府県薬務課に相当する機能を有しており、実際の査察活動を行う査察官が配置されている。
査察の決定はFDA本部で行われるが、実際の査察はOII職員が執行する。OIIは世界規模での査察権限を持ち、国際的な規制執行活動を展開している。また、税関にも職員を配置し、輸入品の抜き取り調査を実施している。
組織改編に伴い、以下の新部署が設置された。
- バイオ研究監視部
- 医療機器放射線安全監視部
- 輸入監視戦略室
これらの部署は、それぞれの専門分野における監視・監督機能を強化している。
4. Office of Complianceの機能と権限
各センターに設置されているOffice of Complianceは、規制遵守の監視・監督において中心的な役割を果たしている。特にSSM(Site Selection Model)モデルを活用して査察の優先順位を決定する重要な機能を担っている。
査察官から提出される査察報告書(Establishment Inspection Report:EIR)の受理・評価も担当している。Form 483は査察官が査察現場で発行する査察所見書であるが、Warning Letterは各センターのCompliance Officeが発行する。