
ER/ES実践講座(第3回) ERESガイドラインの考察 (その1)
ERESガイドラインの考察 (その1)
ER/ES実践について研究するページです。
*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
1. はじめに
「医薬品等の承認又は許可等に係る申請等に関する電磁的記録・電子署名利用のための指針」(以下、ERESガイドライン)が平成17年4月1日に発出され、もう間もなく3年が過ぎようとしている。
医薬品開発における電子化は、EDCシステムやeCTDシステムに代表されるように、急速に進化しつつある。
しかしながら拙速な電子化は危険である。電磁的記録及び電子署名は、紙の記録や紙の記録への手書き署名又は捺印に比べて、改ざんが容易であり、またそれを発見することが難しい。本シリーズで紹介している通り、電子化のリスクを正しくとらえ、紙の記録では必要のなかった特別な管理要件を加味した上で、慎重に電子化を図っていかなければならない。
ERESガイドラインの目的は、電磁的記録による申請資料等の信頼性を確保することである。
その目的を達成するために、電磁的記録の「真正性」、「見読性」及び「保存性」を確保しなければならない。
本稿では数回に分けて、ERESガイドラインを詳細に考察してみたい。
2. ERESガイドラインの構成
ERESガイドラインの構成(図1参照)は、前半部分(3.1.3まで)は、平成11年に発表された電子カルテのガイドラインと良く似ている。共に「真正性」、「見読性」及び「保存性」の要件があり、それらの順序も同じである。
また後半部分(3.2以降)は、21 CFR Part 11(以下、Part11)と良く似ている。クローズド・システムとオープン・システムという概念は、最初にPart11で定義されたものである。
| 目的用語の定義電磁的記録利用のための要件 3.1 電磁的記録の管理方法 3.1.1 電磁的記録の真正性・・・本物か? 3.1.2 電磁的記録の見読性・・・いつでも書面に戻せるか? 3.1.3 電磁的記録の保存性・・・長期保存ができるか? 3.2 クローズド・システムの利用 3.3 オープン・システムの利用電子署名利用のための要件その他 |
図1 ERESガイドライン
ERESガイドラインでは、電磁的記録の「真正性」、「見読性」及び「保存性」の確保を求めている。それぞれを一言で解説すると、「真正性」は「本物か?」ということであり、「見読性」は「いつでも書面に戻せるか?」、「保存性」は「長期保存ができるか?」ということである。
電磁的記録は紙の記録に比べて、改ざんが容易であり、改ざんの発見が難しい。従って規制当局の懸念は、申請された資料や査察時に調査する資料が「本物であるか?」ということである。
また電磁的記録は直接人の目では読めないため、当該情報を記録した電磁的記録媒体を操作するドライブ装置と、当該情報を読み出すためのソフトウェアが必要となる。紙の記録の場合は、資料保管庫においてすぐさま参照することができる。それに対して電磁的記録の場合は、上記のようなしくみ(装置)が必要となるのである。従ってそれらしくみが、資料保管庫(つまり電磁的記録媒体を保管してある場所)からそう遠くなく、適切な場所に配置されている必要がある。さらにそのしくみでは、電磁的記録を書面の形式でディスプレイに表示が可能で、またプリンター装置によって印刷が可能でなければならない。
さらに電磁的記録媒体は経年劣化するので、長期間の記録の保存には配慮が必要である。紙の記録の場合は、保存状態が良ければ、何十年もの期間劣化させることなく保存することができる。それに対して、一般に使用されている磁気ディスクのような電磁的記録媒体の場合は5年であり、CD-Rの場合はせいぜい10年がその保証期間である。つまり電磁的記録媒体はその保証期間内で使用し、期間が超えないうちに電磁的記録を新しい電磁的記録媒体に移行させる必要性がある。
3. ERESガイドラインの適用範囲
当該通知によると、「申請等に関する資料及び当該資料の根拠となるいわゆる原資料を電磁的記録により提出又は保存する場合の留意事項」とある。(図2参照)
| 医薬品、医薬部外品、化粧品及び医療機器(以下「医薬品等」という。)の承認又は許可等並びに適合性認証機関の登録等に係る申請、届出又は報告等(以下「申請等」という。)に関する資料及び当該資料の根拠となるいわゆる原資料(以下「原資料」という。)について、今般、下記のとおり、電磁的記録により資料及び原資料を提出又は保存する場合の留意事項をとりまとめたので、御了知の上、貴管下関係業者に対し指導方ご配慮願いたい。 (中略) 3. 適用範囲 別紙の指針は、以下の場合に適用すること。 薬事法及び関連法令に基づいて、医薬品、医薬部外品、化粧品及び医療機器の承認又は許可等並びに適合性認証機関の登録等に係る申請、届出又は報告等にあたって提出する資料として電磁的記録又は電子署名を利用する場合原資料、その他薬事法及び関連法令により保存が義務づけられている資料として電磁的記録及び電子署名を利用する場合なお、薬事法及び関連法令に基づいて、医薬品、医薬部外品、化粧品及び医療機器の承認又は許可等並びに適合性認証機関の登録等に係る申請、届出又は報告等にあたって提出する資料、原資料、その他薬事法及び関連法令により保存が義務づけられている資料を紙媒体で作成する際に電磁的記録及び電子署名を利用する場合にあっても、可能な限りERESガイドラインに基づくことが望ましいこと。 |
図2 通知文抜粋
ERESガイドラインでは、当局に提出した書面を「資料」と呼んでいる。また「原資料」とは、当局に提出した「資料」を作成するための根拠とした資料のことである。(図3参照)
GCPで言うところの「原資料」とは定義が違うので注意が必要である。「原資料」は、製薬企業で保存しておかなければならない。
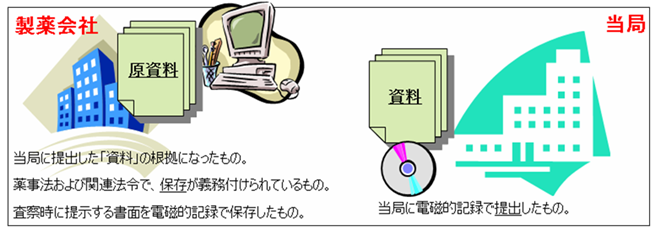
図3 資料と原資料
ERESガイドラインは、当局に書面を電磁的記録により提出する場合と、当局が査察(書面調査)する書面を電磁的記録により保存する場合の要件であるといえる。
従って、これら書面を紙媒体で作成したり、紙媒体で保存する場合には基本的には適用を受けないことになる。
しかしながら通知文には「なお、薬事法及び関連法令に基づいて、医薬品等の申請等にあたって提出する資料、原資料を紙媒体で作成する際に電磁的記録及び電子署名を利用する場合にあっても、可能な限りERESガイドラインに基づくことが望ましいこと。」とのくだりがある。
つまり記録を電子的に作成した時点で、ERESガイドラインの適用を受けることとなる。
| 4. 適用期日 本指針は、原則として平成17年4月1日以降に提出又は保管される資料について適用することとすること。 |
図4 適用期日
また適用期日には「本指針は、原則として平成17年4月1日以降に提出又は保管される資料について適用することとすること。」とある。(図4参照)
電磁的記録がERESガイドライン発効日以前に作成されていたとしても、その電磁的記録を平成17年4月1日以降に提出する場合には、適用を受けることになるので、注意が必要である。
また前号でも解説したとおり、電磁的記録により保存及び作成できる書面であるか否かは、厚生労働省令第44号に従わなければならない。
4. ERESガイドラインの目的
通知文の趣旨には「薬事法の趣旨を踏まえ、電磁的記録による申請資料等の信頼性を確保する」と記載されている。
つまりERESガイドラインの目的は、電磁的記録による申請資料等の信頼性を確保することである。(図5参照)
| 1. 趣旨 (中略) 上記の法令及び通知により、医薬品等の申請等においても、申請者等が提出する資料については電磁的記録により対応することが可能であるが、薬事法の趣旨を踏まえ、電磁的記録による申請資料等の信頼性を確保するため、今般、電磁的記録により資料及び原資料を提出又は保存する場合等の留意事項を定めることとしたものであること。 |
図5 趣旨
言い換えると電磁的記録及び電子署名を紙の記録及び手書き署名又は捺印と同等レベルの信頼性を有すると認めることのできる要件を示したものである。(図6参照)
| 1.目的 本指針は、医薬品、医薬部外品、化粧品及び医療機器(以下「医薬品等」という)の承認又は許可等並びに適合性認証機関の登録等に係る申請、届出又は報告等(以下「申請等」という)に関する資料及び原資料について、電磁的記録及び電子署名を利用する際の必要な要件を定めたものである。 |
図6 目的
5. 用語の定義
| 2.用語の定義 本指針で用いる用語の定義は、「民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律」によるものの他、次のとおりとする。電磁的記録媒体 磁気ディスク、光ディスク、磁気テープ等の、電磁的記録を保管するためのもの。電子署名 電磁的記録に対し、手書き署名又は捺印と同等のものとして行われる署名で、個人又は法人が作成、採用、確認、承認する一連の記号を電子化して構成したデータ。デジタル署名 署名者認証の暗号化技術等に基づく電子署名。クローズド・システム システム内の電磁的記録に責任を持つ者によって、システムへのアクセスが管理されているシステム。オープン・システム システム内の電磁的記録に責任を持つ者によって、システムへのアクセスが管理されていないシステム。監査証跡 正確なタイム・スタンプ(コンピュータが自動的に刻印する日時)が付けられた一連の操作記録。 |
図7 用語の定義
ERESガイドラインでは、民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律(以下、e-文書法)の用語の定義も参照することとしている。(図7参照)
平成15年6月4日に厚生労働省医薬局審査管理課が指針(案)を発表した際には、e-文書法は存在しなかった。その際には電磁的記録の定義があったが、発行されたERESガイドラインでは電磁的記録の定義がなくなっている。
e-文書法によると「電磁的記録」とは、「電子的方式、磁気的方式その他人の知覚によっては認識することができない方式で作られる記録であって、電子計算機による情報処理の用に供されるものをいう。」とある。
また保存とは、「民間事業者等が書面又は電磁的記録を保存し、保管し、管理し、備え、備え置き、備え付け、又は常備することをいう。」とある。
一般に資料はある一定期間(例えば1年間)はアクセスが頻繁に行われる。その間は資料を維持管理するが、これを保管と呼ぶ。アクセスがあまり行われなくなった際には、資料をアーカイブすることになるが、この状態が保存である。すなわち保存とは資料を長期間維持することを指す。また保管は保存の一時点であるといえる。
- 電磁的記録媒体
電磁的記録媒体は、電磁的記録を保存する目的で使用される、ハードディスク、光ディスク、磁気テープ等のメディアをいう。さらに電磁的記録をバックアップする目的で使用する場合もある。
従って電磁的記録を一時的に保持する目的で使用されるUSBメモリーなどは、電磁的記録媒体とは見なさない。
記録の長期保存を行うため、電磁的記録媒体は、当該記録の保存期間を満たす期待寿命を持つことが望ましい。 - 電子署名
電子署名とは電子的に署名を行う行為をいう。紙媒体において署名または記名・捺印を行う場合と同等の責任を有するものである。
電子署名は電磁的記録の本人性の証明に用いられる。
ERESガイドラインでは、電子署名法に基づき電子署名の管理・運用に係る手順を文書化することを求めている。しかしながら電子署名の定義は電子署名法によるとはしないで、ここに定義されていることは混乱を招くと思われる。 - デジタル署名
デジタル署名は、暗号化技術等により、当該個人又は法人であることの認証及び当該データについて改変(変更及び改ざん等)が行われていないことの確認ができる署名技術である。
つまりデジタル署名は、電子署名を実現する技術の一つである。しかしながらデジタル署名のみが電子署名ではないことに注意が必要である。
インターネットなどのオープンな環境を使って電磁的記録を送信する場合などは、盗聴・改ざん・なりすましといったリスクが伴う。これらリスクによって電磁的記録の真正性が保証できない事態となるのである。
盗聴を防止するためには、電磁的記録の暗号化が必要であり、改ざん・なりすましを防止するためには、デジタル署名(またはそれに代わる技術)が必要とされる。 - クローズド・システム
電磁的記録を作成したシステムで当該電磁的記録を維持管理する場合をいう。
その場合、ユーザIDとパスワードの組合せおよび監査証跡機能により、電磁的記録の真正性を確保することができる。つまり本人性の証明と非改ざん証明が可能である。 - オープン・システム
クローズド・システムと別のクローズド・システムをネットワーク等により接続した形態を、オープン・システムと呼ぶ。従ってオープン・システムという「システム」が存在するものではない。
電磁的記録を当該システムからオープンな環境に送信したり、電磁的記録媒体を介して受け渡す場合、電磁的記録が作成されてから受け取られるまでの間の真正性、機密性を確保するために必要な手段を適切に実施する必要がある。
電磁的記録を作成したシステムから当該電磁的記録がネットワークや電磁的記録媒体を介して外に出る場合、 IDとパスワードの組合せおよび監査証跡機能を利用することができない。従ってオープンな環境において真正性を確保するためには、デジタル署名を利用しなければならない。また機密性を確保するためには、電磁的記録の暗号化が必要となる。 - 監査証跡
ERESガイドラインが定義する監査証跡とは操作記録のことである。しかしながら一般に監査証跡は変更履歴のことと同義と理解されているので注意が必要である。
操作記録は正確なタイム・スタンプが付けられていなければならない。タイム・スタンプは、当該電磁的記録の存在証明を行うために使用される。
タイム・スタンプはコンピュータのクロックをもとに、自動的に記録される。従ってコンピュータのクロックは、日常正確に調整されていなければならない。またNTP等の外部のクロックと同期させていることが望ましい。
監査証跡は変更可能であってはならない。平成19年12月21日の日本製薬工業協会 医薬品評価委員会開催の「臨床試験データの電子的取得に関するガイダンス説明会」において、医薬品医療機器総合機構の井本 昌克氏は次のように述べている。「監査証跡の堅牢性及び網羅性が当該システムの最後の砦。監査証跡自体が失われる、あるいは改ざんされるようなことがあれば、全体としての信頼性は担保できない。しかし、監査証跡自体の改変を100%プロテクトすることは、技術的に困難。種々な対策を併用する必要がある。」
6. おわりに
ERESガイドラインが発行されてからもう間もなく3年が過ぎようとしている。この間何もしていなかったでは済まされない。
正しいERESガイドライン対応は、正しいERESガイドラインの解釈から始まる。次号でも引き続き、ERESガイドラインの考察を続けたい。
参考
- 「民間事業者等が行う書面の保存等における情報通信の技術の利用に関する法律」平成16年 法律第149号
- 「医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について」平成17年4月1日 薬食発第0401022号
- 「臨床試験データの電子的取得に関するガイダンス説明会資料」平成19年12月21日 日本製薬工業協会 医薬品評価委員会
- 「Title 21 of the Code of Federal Regulations Part 11,“Electronic Records; Electronic Signatures”」 FDA 1997.3.20





