基本要件基準とは
基本要件基準とは
医療機器の承認基準とは
「承認基準」とは、その基準への適合性を確認することにより承認審査を行う医療機器に関する基準をいう。
「承認基準」は、原則、国際基準等からなり、臨床試験成績に関する資料の添付が不要の範囲の品目について定めている。
承認基準の内容
1.適用範囲
対象となる医療機器を一般的名称で指定
2.技術基準
性能、機能、有効性に関する項目等
3.使用目的、効能又は効果
基準の対象となる使用目的、効能又は効果を限定
4.基本要件への適合性
基本要件への適合性を説明
5.その他
構造、使用方法、性能等が既存の医療機器と明らかに異なる場合については、基準に適合しないものとすること。
医療機器の承認基準のうち4番目が基本要件基準への適合性である。なお、医療機器の認証基準においても同様に基本要件基準への適合が求められる。
基本要件基準とは
基本要件基準とは、すべての医療機器又は体外診断用医薬品が具備すべき品質、有効性及び安全性に係る基本的要件を規定したものである。
医療機器の製造販売承認・認証申請または製造販売届出の際には、基本要件基準への適合性に関する資料を提出しなければならない。
医療機器の基本要件基準:
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準」(平成17年厚生労働省告示第122号)
体外診断用医薬品の基本要件基準:
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第四十一条第三項の規定により厚生労働大臣が定める体外診断用医薬品の基準」 (平成17年厚生労働省告示第126号)
2005年にGHTF (Global Harmonization Task Force/医療機器規制国際整合化会議)は、「あらゆる医療機器・体外診断用医薬品の使用を想定したときに、主に安全性を確保するために設計・製造上必要となる事項に関して共通する要件」(=基本要件)を規定した。(GHTF/SG1/N41R9:2005)
この基本要件は2012年に改訂され最終文書(GHTF/SG1/N68:2012)として公表された。
その後、2018年にはIMDRF(International Medical Device Regulators Forum/国際医療機器規制当局フォーラム)の文書「Essential Principles of Safety and Performance of Medical Devices and IVD Medical Devices」(IMDRF/GRRP WG/N47 FINAL:2018)に置き換えられた。
日本においても国際整合を踏まえ「基本要件基準」(平成17年厚生労働省告示第122号)が平成17年(2005年)に制定された。
なお、薬機法の改正に伴い、令和3年(2021年)8月に、基本要件基準が改正された。
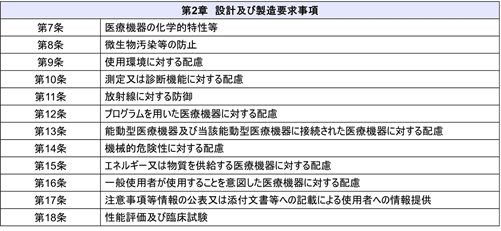
加えて「医療機器に係る基本要件適合性チェックリスト」もそれに伴い改定された。 基本要件基準は「第1章 一般的要求事項」と「第2章 設計及び製造要求事項」で構成されている。

現状において、第2条の「リスクマネジメント」において「サイバーセキュリティ」が含まれていると解釈されている。 しかしながら、2023年夏に基本要件基準が改正され、サイバーセキュリティ要求事項が明確化される予定であり、「製品のライフサイクル全体を通じて、システムの再現性、信頼性及び性能を発揮できるよう、設計及び製造されなければならない」との趣旨が基本要件基準に盛り込まれる方向である。
基本要件適合性チェックリストとは
「医療機器に係る基本要件適合性チェックリストについて」(薬生機審発0818第1号)において、基本要件適合性チェックリストが提供されている。
医療機器を申請する場合、基本要件適合性チェックリストに「該当する社内文書番号等」という列を加え、当該情報を記載している資料を特定することになる。 詳細は「医療機器プログラムの製造販売認証申請書添付資料の記載事例」参照。

医療機器認証基準と基本要件基準
認証品については、基本要件基準に適合することを確認するためのチェックリストが個別に定められている。
「当該機器への適用・不適用」、「適合の方法」、「特定文書の確認」に記載されている内容は、科学的に妥当な理由があれば変更しても差し支えないこととされている。 ただし、 「当該機器への適用・不適用」に変更がある場合には当該機器の「使用目的又は効果」又は「一般的名称の定義」を逸脱する恐れがあるため、事前に登録認証機関への照会が必要となる。