
製薬企業ではなぜCAPAの導入が遅れているのか?
製薬企業および医療機器企業において、CAPA(是正処置・予防処置)を導入することは至上命題である。
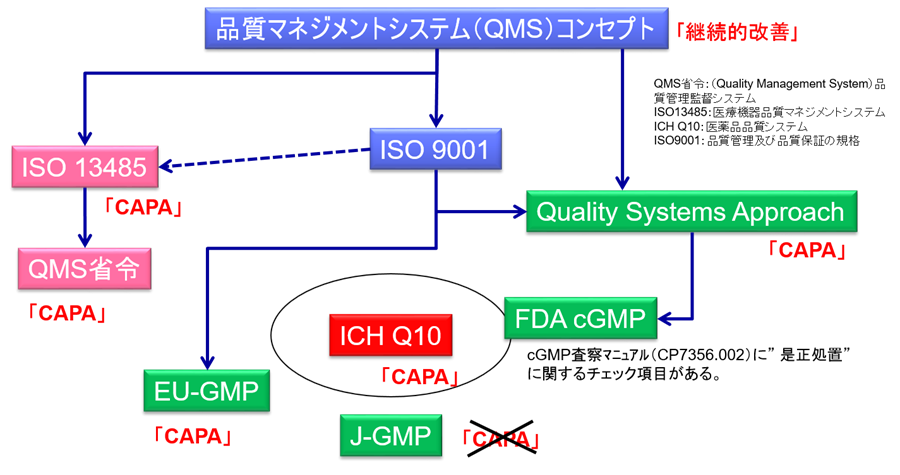
医療機器業界においては、ISO-13485およびQMS省令などでCAPAが要求されており、程度の差こそあれども、どの企業もインプリメントは終えているはずだ。
しかしである、製薬企業ではまだCAPAを導入していない企業が多くある。
というよりもCAPA事態を知らない企業も存在する。
その理由は、GMP省令などの本邦の規制要件でCAPAが要求されていないためである。
米国では、cGMPには直接記載がないものの、2006年に発行された「cGMPの品質システムからのアプローチ」と呼ばれるガイダンスにおいて、CAPAを要求している。
また欧州においても、PIC/S GMPでCAPAが明確に要求されている。
本邦において、唯一記載があるのは、2010年に課長通知として発出されたICH-Q10「医薬品品質システム」のみである。(下図参照)
CAPAに関する規程・手順書・様式

| 【FDA CFR 820 QSR対応】 CAPA規程・手順書・様式 |
| FDA QSRに沿った形のCAPAに関する規程・手順書・様式集です。 QSR(品質システム規則)査察で最も指摘が出されているのがCAPAです。 これから作成する医療機器企業やISO-14971認証審査を予定している企業、認証機関から改善指示を受けた企業向けに、サンプルをご用意いたしました。 MS-Word形式ですので、貴社でご自由に加筆・修正を行っていただけます。 |
ご購入はこちら。

| 【ISO-13485:2016対応】 CAPA規程・手順書・様式 |
| ISO-13485:2016に沿った形のCAPAに関する規程・手順書・様式集です。 QSR(品質システム規則)査察で最も指摘が出されているのがCAPAです。 これから作成する医療機器企業やISO-14971認証審査を予定している企業、認証機関から改善指示を受けた企業向けに、サンプルをご用意いたしました。 MS-Word形式ですので、貴社でご自由に加筆・修正を行っていただけます。 |
ご購入はこちら。
≪様式一覧≫
※ご注文いただきますと、以下の様式を電子メールにて Wordファイル形式で納品いたします。
・ MD-QMS-F1701 CAPAフォーム
・ MD-QMS-F1702 CAPA一覧表
・ MD-QMS-F1703 CAT会議記録
・ MD-QMS-K17 是正処置・予防処置実施規程
・ MD-QMS-S1701 是正処置・予防処置実施手順書




