
GAMPの経緯
GAMPの誕生と初期発展
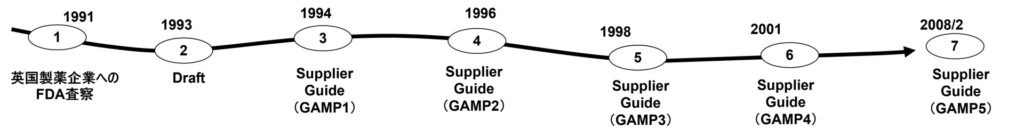
1991年、米国食品医薬品局(FDA)の査察官ロン・テスラが英国製薬企業を査察した。この査察で、グラクソ社(現:グラクソスミスクライン社)およびICI社(現:アストラゼネカ社)にWarning Letterが発行され、医薬品レベルの品質管理が不足しているとの指摘を受けた。
グラクソ社は、査察で指摘された事項に対する是正措置が完了するまで、新製品の上市が認められなかった。
FDAは1992年に、是正措置の完了を求めるレターをグラクソ社に発行した。
FDAの指摘の多くが食品レベルの製造管理、品質管理を実施しており、医薬品レベルではなかったことによる。また指摘の多くが構造設備に対するものであり、サプライヤに対して医薬品レベルの品質管理を教育しなければならないことが明確となった。
これは、製薬業界におけるコンピュータバリデーションの普及を促進する上で大きな転換点となった。

GLAXOはもともと幼児用の粉ミルクの登録商標
この事態を受け、英国ではコンピュータバリデーションのガイドライン作成のためのワーキンググループが結成され、1993年には、アリスタとトロフセンがGAMPの草案作成のための情報収集を目的にメンタ社を訪問し、重要な知見を得た。
さらに、英国MCA(Medicines Control Agency、現MHRA:Medicines and Healthcare products Regulatory Agency)が参画することで、規制当局の視点が反映された。
翌1994年2月にはロンドンで最初の国際会議が開催され、サプライヤー向けガイダンスの草案が発表された。
1995年にはGAMP 1が正式に発表された。
GAMPはサプライヤー向けのガイダンスであって、製薬企業向けではない。また、GAMPは「ガイダンス」であって、「ガイドライン」ではない。
この後、GAMP 2(1996年)、GAMP 3(1998年)、GAMP 4(2001年)と約2年おきに改訂が重ねられ、内容が大幅に拡充された。
GAMP 4の問題点
GAMP 4は多くの利点を持ちながらも、以下のような課題が指摘された。
1. リスクベースアプローチの不十分さ
システムの重要度に関わらず、同じレベルの文書化と検証が要求された。
これにより、低リスクシステムにも過剰な検証作業が必要となり、結果として不必要なコンプライアンスコストが発生した。
2. ソフトウェアカテゴリの硬直性
カテゴリ分類が1~5まで固定的で、新しい技術やシステムへの対応が困難であった。分類が曖昧なケースの判断基準が不明確であったため、実務での混乱を招いた。
3. コスト効率の低さ
過度な文書化要求や画一的な検証アプローチにより、プロジェクト期間が長期化。結果として、コンプライアンスコストが増大した。
4. ITアプリケーションへの適用の難しさ
構造設備中心のプロセスバリデーション用語(DQ、IQ、OQ、PQなど)が使用されており、ITアプリケーションには適用しにくかった。
これらの用語は、サプライヤーにとっては意味が不明瞭である場合も多かった。
5. サプライヤーと製薬企業間の作業の二重化
製薬企業とサプライヤーの双方で重複する作業が発生し、非効率性が指摘された。
これらの課題により、GAMP 4は製薬企業に過剰な負担を課し、その影響が製品価格に反映されることで、患者の経済的負担を増大させる一因ともなった。特筆すべきは、製薬企業が規制遵守に要したコスト(コンプライアンスコスト)は最終的に薬価に転嫁される傾向がある点である。
FDA近代化法と規制環境の変革
1997年、アメリカ議会で可決されたFDA近代化法(FDAMA)は、医薬品・医療機器の規制に関する広範な改革を求めた。その後、2002年には「21世紀のGMPイニシアチブ」が開始され、品質マネジメントシステムの強化とリスクベースアプローチの導入が推進された。これらの取り組みは、製薬業界における新たな製造アプローチの確立を支援するものとなった。
PATとASTM E55委員会の影響
2001年頃から、FDAは化学品業界では当たり前となっているProcess Analytical Technology(PAT)の普及を推進したが、当初は医薬品業界での適用が進まなかった。この状況を改善するため、2004年にASTM E55委員会が設立され、製薬製造プロセスの標準化を目指す枠組みが強化された。
2007年には、ASTM E2500 「医薬品・バイオ医薬品の製造システムの利用・設計・ベリフィケーションに関するガイドライン」が発出された。
GAMP 5の確立と現代化
ASTM E2500等の影響があり、GAMPは大きな転換点を迎え、2008年にGAMP 5が発表された。この新版では、リスクベースアプローチが全面的に導入され、タイトルもGAMP 4の「GAMP Guide for Validation of Automated Systems」から「A Risk-Based Approach to Compliant GxP Computerized Systems」へと変更された。ASTM E2500に整合させるため、タイトルからValidationという用語が消えたことは注目に値する。
またこの変更は、従来の「Automated Systems」(構造設備中心)から「Computerized Systems」(ITアプリケーション中心)への焦点の移行を示すものであった。
2022年には、GAMP 5の第2版が発行され、最新の技術や規制要件に対応した内容へと更新された。現在のGAMPは、当初の医薬品製造におけるコンピュータ化システムのバリデーションという焦点から、製薬業界全体のコンピュータ化システムの品質保証と規制遵守のための包括的なガイドラインへと発展している。






