
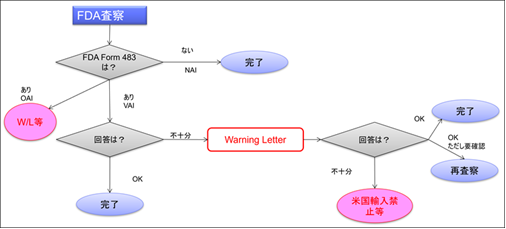
FDA査察実施から完了までのフロー
FDA査察実施から完了までのフロー
米国FDAの査察は、製薬企業や医療機器企業にとって重要な規制遵守の一環である。査察の目的は、製品の品質と安全性を確保し、患者保護を強化することにある。査察が実施された後、違反が発見された場合、FDAはWarning Letterを発行することがある。
FDA査察からWarning Letterが発行されるまでのプロセスは、企業にとって重大な意味を持つ。適切な対応を怠ると、製品の販売停止や企業の信用失墜といった深刻な結果を招く可能性がある。したがって、日常的な規制遵守の徹底と、査察に対する迅速かつ適切な対応が求められる。企業は、常に高い品質基準を維持し、消費者の安全を最優先に考える姿勢を持つことが重要である。
今回は、査察からWarning Letterが発行され、査察が完了するまでのプロセスについて解説する。
FDA査察の評価
FDA査察が完了した際、査察官は以下の3つのレベルに分類した評価を行う。
- NAI:No Action Indicated(措置指示無し)
指摘事項なし。これが最も好ましい評価である。この場合、Form 483(Notice of Inspectional Observations)は発行されない。EIR(Establishment Inspection Report)が作成され、査察完了後約60日で送付されてくる。送付されない場合は、FDAに要求すること。 - VAI:Voluntary Action Indicated(自主的措置指示)
指摘はあったが、FDAからは何の行政措置もない。この場合Form 483が発行される。企業は指摘事項に回答する必要がある。 - OAI:Official Action Indicated(強制措置指示)
重大な指摘があり、FDAから行政措置がとられる。これが最も悪い評価である。場合によっては、Form 483が発行されず、後日Warning Letterが送付されてくることがある。
FDA査察実施から完了までのフロー
Form 483には、査察官が発見した具体的な問題点や不適合事項が詳細に記載される。企業はForm 483を受け取り、指摘された事項に対する対応策を検討する必要がある。
観察事項への対応
企業はForm 483で指摘された観察事項に対し、迅速かつ適切に対応することが求められる。具体的には、是正措置の計画を立て、実施することが重要である。
是正計画(Response Letter)は、査察完了日から15営業日以内(米国歴日)にFDA本部(査察官宛ではない)に送付しなければならない。理由の如何を問わず15営業日以内にFDAにResponse Letterが届かなかった場合Warning Letterが発行されることがあるので注意が必要である。 企業は、是正措置の進捗状況をFDAに報告し、改善の証拠を提供することが求められる。

是正措置の計画と実施
是正措置の計画には、問題の原因分析と根本的な解決策が含まれる。例えば、製造プロセスの見直しや、従業員の教育訓練の強化、設備の改修などが考えられる。企業は、計画通りに是正措置を実施し、再発防止策を徹底することが求められる。
Warning Letterの発行
観察事項に対する適切な対応が行われない場合、FDAはWarning Letterを発行することがある。このレターは、企業に対し、特定の違反事項を是正するよう強く求める公式な通知である。Warning Letterには、違反の詳細、是正措置の期限、および今後の対応策が記載される。
Warning Letterの影響
Warning Letterを受け取った企業は、速やかに対応策を講じる必要がある。レターに記載された期限内に是正措置を実施し、FDAに報告することが求められる。対応が不十分な場合、さらなる規制措置や法的制裁が課される可能性がある。これにより、企業の信用や市場への影響が懸念される。
査察の完了
NAIの場合(この場合は査察完了)や、Form 483またはWarning Letterに対して対応が完了すると、FDAからEIRが送付されてくる。
いわばEIRはFDA査察のClearance Letterである。これで査察は完了である。
ただしWarning Letterが発行された場合でリスクの高い製品等である場合は、FDAは1年以内に再査察(フォローアップ)を実施することがある。この場合、再査察に合格すれば査察が完了となる。 再査察が実施されず、次回の定期査察で改善状況を調査することになった場合Untitled Letter(WarningでもなくClearanceでもないという意味)が送付されてくることになる。








