
微粒子測定と微生物モニタリング
医薬品の無菌製造において、製造環境の清浄度を維持することは製品の品質と安全性を確保するうえで極めて重要である。しかし、多くの初心者が疑問に思うのは「無菌環境に本当に微生物がいないことをどうやって確認するのか」という点である。実は、現在の技術では生菌数をリアルタイムに測定することは不可能であり、代替手段として微粒子測定が広く用いられている。
微生物のリアルタイム測定の限界
微生物検出において現在の標準的な方法は培養法である。つまり、サンプルを採取し、培地に植え付け、適切な温度で一定期間(通常24〜72時間)培養した後、形成されたコロニーを計数するというものである。この方法は信頼性が高いが、結果を得るまでに時間がかかるため、製造プロセスのリアルタイム制御には向いていない。
現在のところ、空気中の生菌数を即時に検出できる実用的な技術は存在していない。微生物は非常に小さく(多くの細菌は0.5〜5μm程度)、また生きているかどうかを瞬時に判別することが技術的に困難であるためだ。
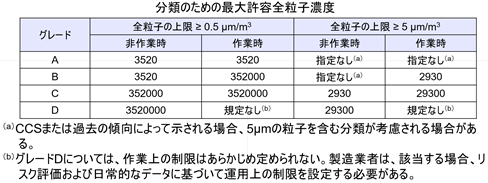
微粒子測定による間接的モニタリング
この技術的制約を克服するため、製薬業界では「微粒子測定」という間接的な方法を採用している。微粒子カウンターを用いて、空気中に浮遊する0.5μm以上の粒子数をリアルタイムで計測するのである。
この考え方の背景には以下のような理論がある。
- 微生物は必ず微粒子として存在する(すべての微生物は微粒子であるが、すべての微粒子が微生物であるわけではない)
- 微粒子数と微生物数には一定の相関関係がある
- 微粒子数が増加すれば、微生物汚染のリスクも比例して高まる
例えば、ISO 14644やGMPガイドラインでは、クリーンルームのグレードごとに微粒子数の上限値が定められており、この数値を満たすことが無菌性確保の一つの指標となっている。
相関関係と限界
重要なのは、微粒子数と微生物数の間に絶対的な相関があるわけではないという点である。微粒子の大部分は非生物由来(塵、繊維、化学物質の結晶など)であり、実際の微生物はその中のごく一部に過ぎない。
これを数字で表すと、例えばGrade A(最も厳格な無菌エリア)環境では、1立方メートルあたり3,520個以下の0.5μm粒子が許容されているが、微生物については1立方メートルあたり1CFU(コロニー形成単位)未満が要求される。この数字からも、検出される微粒子のうち微生物である割合がいかに小さいかが分かる。
総合的な環境モニタリング戦略
このような限界があるため、無菌製造環境の管理においては、以下のような複数の相補的手法を組み合わせた総合的なアプローチが取られている。
- リアルタイム微粒子モニタリング:連続的に環境の清浄度をチェック
- 定期的な微生物サンプリング:落下菌測定、空中浮遊菌サンプリング、表面サンプリングなど
- 環境パラメータの監視:温度、湿度、差圧、気流パターンなど
- プロセスシミュレーション:培地充填試験(Media Fill)など
これらの方法を組み合わせることで、リアルタイム測定の限界を補いながら、製造環境の無菌性を高い確率で保証することが可能となっている。
将来の展望
微生物のリアルタイム検出技術は急速に発展しつつある。例えば、ATP(アデノシン三リン酸)測定法、フローサイトメトリー、バイオセンサー技術などが研究されている。これらの技術が実用化されれば、微生物汚染のより直接的かつリアルタイムな検出が可能になるかもしれない。
しかし、現時点では完全に確立された技術はなく、微粒子測定と従来の微生物試験の組み合わせが依然として主流である。
まとめ
医薬品の無菌製造においては、微生物汚染のリアルタイム検出が技術的に困難であるため、微粒子測定という間接的な方法が広く用いられている。この方法には限界があるものの、他の微生物学的試験と組み合わせることで、製造環境の無菌性を高いレベルで保証することが可能となっている。
製薬業界の専門家は、この「見えないリスク」と日々向き合いながら、科学的根拠に基づいた総合的なアプローチで、患者のための安全で高品質な医薬品製造を実現しているのである。








