医療機器の基本要件基準とは
医療機器は人の命や健康に直接関わる製品であるため、その安全性と有効性を確保することが極めて重要である。そのための基盤となるのが「医療機器の基本要件基準」である。
医療機器の基本要件基準とは、すべての医療機器又は体外診断用医薬品が具備すべき品質、有効性及び安全性に係る基本的要件を規定したものである。GHTF(Global Harmonization Task Force / 医療機器規制国際整合化会議)によって、2005年に「あらゆる医療機器の使用を想定したときに、安全性を確保するために設計・製造上必要となる共通要件」として規定された(GHTF/SG1/N41R9:2005)。日本においても国際整合を踏まえ、「基本要件基準」(平成17年 厚生労働省告示第122号)が2005年に制定された。
医療機器の製造販売承認・認証申請または製造販売届出の際には、基本要件基準への適合性に関する資料を提出しなければならない。この基準を満たさない場合は、申請書が受理されないか、却下されるか認証/承認されない。つまり、基本要件基準への適合は医療機器が市場に出るための必須条件である。
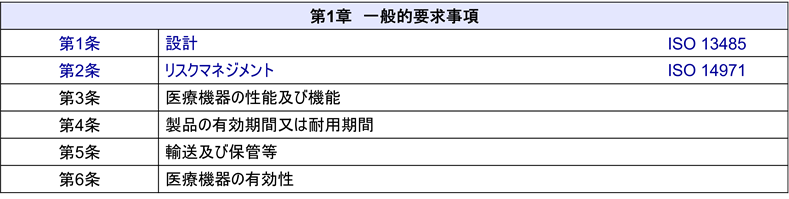

基本要件基準の構成
基本要件基準は、大きく以下の要素から構成されている。
1. 設計・製造に関する一般的要求事項
医療機器は使用目的や効能・効果を達成できるよう設計・製造される必要がある。また、患者や使用者に対するリスクを最小化するための要件が定められている。具体的には安全性の確保、リスクの最小化、長期的な安全性と信頼性、輸送・保管時の品質維持が求められる。
2. 性能に関する要求事項
医療機器が本来の機能を発揮するための性能要件が規定されている。例えば、測定機器であれば測定精度、治療機器であれば治療効果の安定性などが含まれる。
3. 安全性に関する要求事項
患者や使用者の安全を確保するための要件であり、機械的安全性、電気的安全性、生物学的安全性、放射線安全性、熱的安全性などが含まれる。
4. 表示・添付文書に関する要求事項
使用者が適切に医療機器を使用するために必要な情報提供に関する要件が規定されている。これには機器の識別情報、警告や注意事項、使用方法の説明、保守点検に関する情報が含まれる。
国際的な整合性と医療機器のグローバル展開
国際整合が重要である最大の理由は、医療機器が国境を越えて使用されるためである。日本の基本要件基準はGHTFのER(Essential Requirements)をほぼ翻訳したものであり、グローバルの各国・地域でも同様の枠組みが採用されている。
例えば、欧州連合(EU)ではMDR/IVDRのAnnex IにあるGSPR(General Safety and Performance Requirements)、オーストラリアのTGAの必須原則、カナダのHealth Canadaの安全性・有効性要件、ブラジルのANVISAの規制要件もGHTFのERに基づいている。現在はIMDRF(国際医療機器規制当局フォーラム)がこの整合化の取り組みを引き継いでいる。
各国における規格の参照方法
各国・地域では、基本要件基準を満たすための規格参照方法に特徴がある。
日本: ISO/IECの国際規格ではなく、それらを国内規格化したJIS規格を参照する。基本要件基準自体には国際規格は直接参照されていないが、厚生労働省医薬・生活衛生局医療機器審査管理課長通知により、要求を満たすためのJIS規格が推奨されている。
欧州連合: ISO/IEC規格を欧州規格(EN)として採用したものを参照し、調和規格(harmonized standards)として位置づけている。
米国: FDAが認める規格(Recognized Consensus Standards)として、ANSI規格やASTM規格、特定のISO/IEC規格も直接参照している。
各国で国際規格の採用方法や名称に違いはあるものの、基盤となる技術要件は実質的に同等であり、国際整合性が確保されている。
基本要件への適合性証明
医療機器の製造業者は、製品が基本要件基準に適合していることを以下の方法で証明する。
1. 認証規格への適合
JIS規格やISO規格などの認証規格への適合を示すことで、基本要件基準の特定要素への適合性を証明できる。
2. リスクマネジメント
ISO 14971に基づくリスクマネジメントを実施し、リスクが許容可能なレベルに管理されていることを示す。このプロセスは製品ライフサイクル全体を通じて継続的に実施される。
3. 臨床評価
必要に応じて臨床試験や既存の臨床データを評価し、医療機器の有効性と安全性を証明する。特に新規性の高い医療機器や高リスクの医療機器では重要となる。
4. 技術文書の作成
上記の証明資料を含む技術文書を作成し、規制当局の審査を受ける。この文書には設計仕様、試験報告書、リスク分析結果、使用説明書案などが含まれる。
まとめ
医療機器の基本要件基準は、医療機器の品質、有効性、安全性を確保するための基盤となる重要な要件である。GHTFの主導により国際的に整合化された考え方に基づいており、各国・地域の規制の根幹をなしている。
この基準に適合することで、患者や医療従事者の安全を守り、高品質な医療機器のグローバルな普及を促進することができる。医療機器に関わるすべての関係者がこの基本要件基準の意義と国際的な整合性を理解し、適切に対応することが、医療の安全と発展、そして革新的な医療機器の世界的な普及につながるのである。
関連商品