
品質リスクマネジメントに関するSOP作成方法
品質リスクマネジメントに関するSOPは、単に企業または部門で1冊作成すれば十分というものではない。
医薬品品質システム(PQS)全体に品質リスクに関する概念を組み込み、既存のすべてのSOPに品質リスクマネジメントの要素を統合的に盛り込んでいく必要がある。
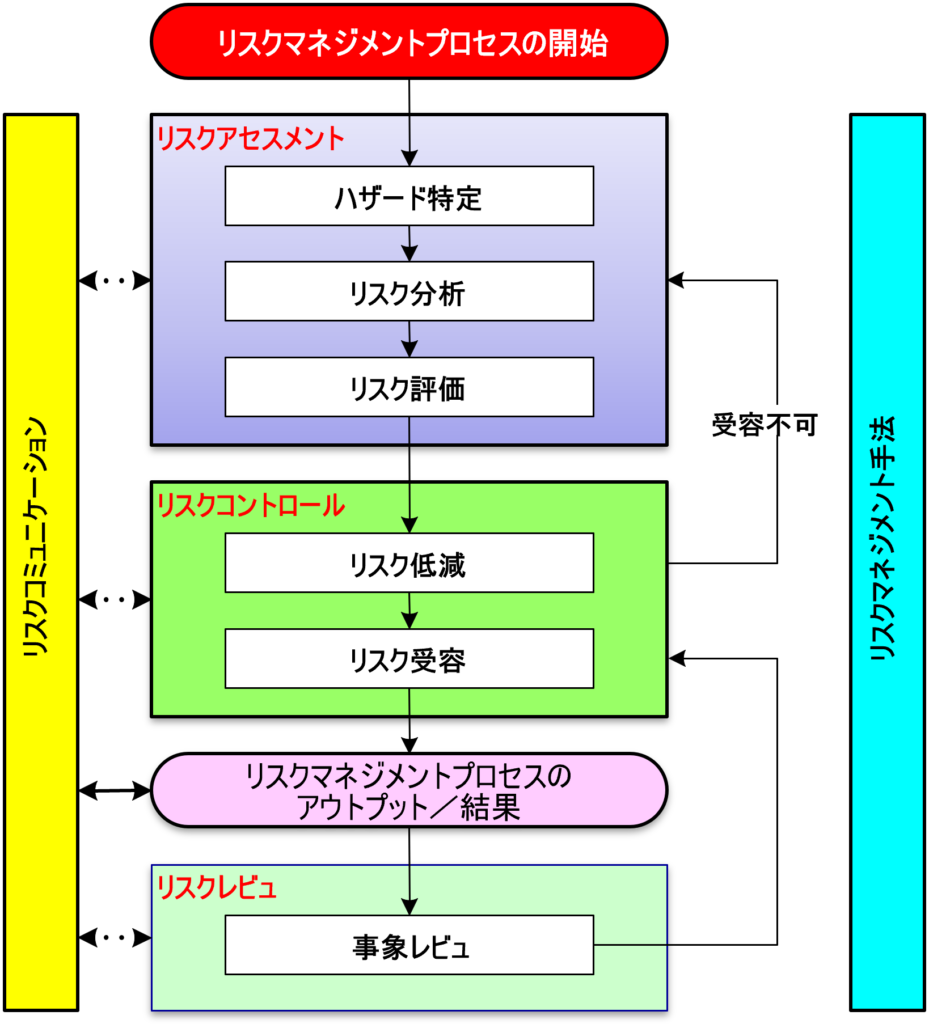
リスクマネジメントの主要プロセス
1. リスクの発見(リスクアセスメント)
適用対象となるすべての部門において、品質を脅かすリスク(プロセス)を体系的に特定する必要がある。
以下に主要な失敗事象を示す(これらに限定されない)。
1.1 構造設備関連のリスク
構造設備等の故障や不具合は、製品品質に重大な影響を及ぼす可能性がある。
1.2 ヒューマンエラー関連のリスク
以下のような様々な形態のヒューマンエラーが発生する可能性がある。
- 構造設備等の使用における操作ミス
- 分析時における不適切な試薬(期限切れ試薬を含む)の使用
- データ入力ミス
- 転記ミス
- 計算ミス
- 思い込みや勘違いによる判断エラー
- 日常的な手順違反
などが含まれる。
1.3 システム関連のリスク
MS-Excel使用に関するリスク
セキュリティ上の脆弱性や監査証跡の不完全性などが含まれる。
コンピュータシステム関連のリスク
以下のような問題が発生する可能性がある。
- プログラム(分析プログラムを含む)の不具合
- 電子記録の不適切な上書きや削除
- システム時計の異常(不正確なタイムスタンプ、監査証跡の欠如)
1.4 記録管理関連のリスク
2. リスク評価
特定されたリスクについて、その重要度と発生頻度を評価する。
ただし、ヒューマンエラーやソフトウェアエラー(バグ)については、その性質上、発生頻度の予測は行わない。
3. リスクの低減(リスクコントロール)
3.1 リスク低減策の策定と実施
以下の観点から包括的なリスク低減策を講じる。
3.2 手順書の改訂
関連する各部門は、特定されたリスクを低減するための具体的な手順を該当する手順書に追加する。
3.3 データインテグリティの確保
以下の要素を含む包括的なデータ管理体制を確立する。
4. リスクコントロールの有効性モニタリング(リスクレビュー)
すべてのプロセスを継続的に監視し、実施したリスクコントロール策が効果的に機能していることを定期的に評価する。
この評価結果に基づき、必要に応じてリスク低減策の見直しや改善を行う。
- 感熱紙による記録の長期保存における課題
- ハイブリッドシステムにおける電子媒体と紙媒体の整合性管理
- プロセス(運用)の最適化
- 適切なITシステムの導入
- 継続的な教育訓練の実施
- 最新の技術を活用した事故防止策および不正防止策の導入
- データの真正性・見読性・保存性を確保するための具体的手順の策定
- バックアップおよびリストア手順の明確化(バックアップの保管場所を含む)
- アーカイブに関する詳細な手順の策定
- データの適切な破棄手順の文書化
関連商品








