
ALCOA++とは
ALCOA++とは
医薬品・医療機器業界におけるデータインテグリティの確保において、現行のALCOA+に加え、欧州医薬品庁(EMA)が新たに「トレーサビリティ」を追加したALCOA++への対応が新たな課題として浮上している。ALCOA++は、従来のALCOA(Attributable:帰属性、Legible:判読性、Contemporaneous:同時性、Original:原本性、Accurate:正確性)とALCOA+(Complete:完全性、Consistent:一貫性、Enduring:永続性、Available:利用可能性)を基盤として、トレーサビリティを加えた最新の基準である。特に2021年以降の規制文書において、ALCOA++の概念が正式に採用され、データのライフサイクル追跡が重視されている。
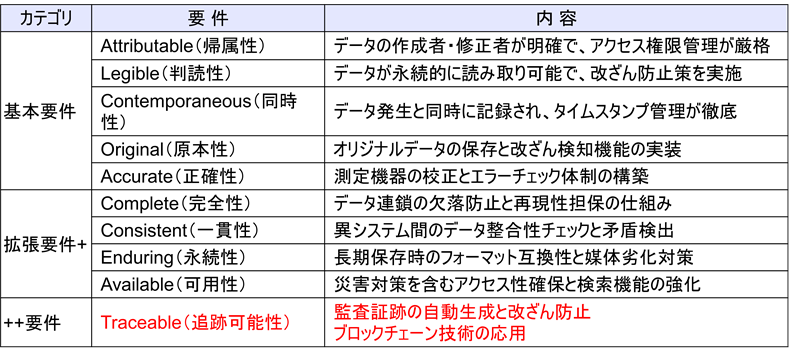
トレーサビリティ要件と規制動向
トレーサビリティの具体的要件として、データの生成から廃棄までの全ライフサイクルの追跡が求められる。EU GMP Annex 11の2023年改定では、監査証跡の完全性と電子記録のトレーサビリティが義務化され、改ざん防止策として暗号化監査証跡の導入が必須となっている。
業界の対応状況
業界の現状について、PIC/S(医薬品査察協定および医薬品査察協同スキーム)では現在もALCOA+基準の適用が主流となっており、ALCOA++はEMAや一部企業による拡張解釈として位置づけられている。
主要計測機器メーカーの対応としては、メトラー・トレドがALCOA+対応の「RecordLOC」システムを提供するなど、段階的な対応が進められている。
日本国内においては、PMDAが現行のALCOA+基準に基づく指導を継続しており、ALCOA++への対応は現時点では企業の自主的な取り組みとして位置づけられている。
WHOガイドラインの変遷
世界保健機関(WHO)のガイドラインについては、2016年版のTRS 996 Annex 5においてALCOA原則の詳細な規定と包括的な指針が示されている。
2021年の改定では適用範囲が医療製品の品質保証に限定されたものの、データインテグリティに関する核心的な要件は維持されている。このガイドラインは、データインテグリティの確保に関する実践的な指針として、現在も多くの専門家に参照されている。
MHRAの独自アプローチ
英国医薬品医療製品規制庁(MHRA)は2018年のガイダンスにおいて、独自のアプローチを採用している。MHRAは「ALCOA+」ではなく「ALCOA」を公式な基準として採用し、CCEA(完全性・一貫性・永続性・可用性)については暗黙の要件として位置付けている。さらに、ALCOA属性を「データ品質」と「データ整合性」の両方に適用可能な基準として明確に定義し、これを規制要件に適した基準として明記している点が特徴的である。
規制当局間の解釈差と実務課題
業界の対応と今後の動向については、多くの専門家が実装ガイドラインとしての実用性の高さから、2016年版WHOガイドラインの継続使用を推奨している。一方で、EMAを中心にトレーサビリティ要件を重視するALCOA++の採用を検討する動きも見られ、EMAの「トレーサビリティ義務化」とMHRAの「自主的対応」といった規制当局間での解釈の差異が、実務上の課題となっている。
ガイドライン間の特徴比較
各ガイドラインの特徴を比較すると、WHO 2016年版ガイダンスはGxP全体を網羅する包括的なアプローチを採用しており、データインテグリティに関する詳細な指針を提供している。これに対し、MHRA 2018年ガイダンスはGMPとGDPに重点を置きつつ、明確なALCOA基準を示している。この違いは、各規制当局の規制アプローチの違いを反映したものといえる。
結論と今後の展望
これらの状況を総合的に判断すると、WHO 2016年ガイダンスの優位性およびMHRAのALCOA解釈に関する指摘は、客観的な事実に基づくものと結論付けることができる。特に、EU GMP Annex 11におけるトレーサビリティ要件の義務化や、規制当局間でのALCOA解釈の差異は、今後のデータインテグリティガイダンスの発展において重要な影響を及ぼす可能性がある。
関連商品








