
医療機器企業におけるソフトウェアバリデーション
医療機器企業におけるソフトウェアバリデーション
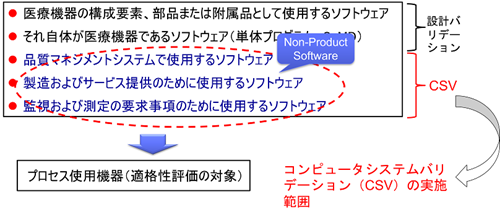
医療機器企業が実施しなければならないソフトウェアのバリデーションの対象は以下の通りである。
- 医療機器の構成要素、部品または附属品として使用するソフトウェア
- それ自体が医療機器であるソフトウェア(単体プログラム、SaMD)
- 品質マネジメントシステムで使用するソフトウェア
- 製造およびサービス提供のために使用するソフトウェア
- 監視および測定の要求事項のために使用するソフトウェア
一方でソフトウェアバリデーションには以下の2種類がある。
- 設計バリデーション
- コンピュータ化システムバリデーション(CSV)

QMS省令やISO 13485において、
「医療機器の構成要素、部品または附属品として使用するソフトウェア」と「それ自体が医療機器であるソフトウェア(単体プログラム、SaMD)」については、設計バリデーションが求められている。
一方でISO 13485:2016において、箇条4.1.6、7.5.6、7.6において、次のソフトウェアに関してバリデーションを要求している。
- 品質マネジメントシステムで使用されるソフトウェア(4.1.6)
- 製造およびサービス提供に使用されるソフトウェア(7.5.6)
- 監視および測定に使用されるソフトウェア(7.6)
これらのソフトウェアは「非製品ソフトウェア(Non-Product Software)」と呼び、CSVが求められている。
一般にISO 13485などの国際規格は要求事項(What)しか記載出来ない。つまり、実施方法(How)は記載してはならないのである。
その理由は、もしHowを記載すれば、その通り実施していない場合、指摘となってしまうためである。
しかしながら、我々が知りたいのはむしろHowである。
そこで、ISOではしばしばTechnical Report(TR)が発行され、具体的なHowが解説される。TRは要求事項ではなく、あくまでも参考である。つまり遵守義務はない。
ISO 13485:2016が要求するCSVの実施方法を解説する規格として、ISO/TR 80002-2が2017年6月に発行された。
ISO /TR 80002-2は、クリティカルシンキングを適用するリスクベースのアプローチを使用してソフトウェアバリデーションの適切な活動を決定するために役立つように作成されている。
つまり、ISO 13485:2016、4.1.6、7.5.6および7.6に含まれているCSVの要件を、製造業者、監査者および規制当局を含むステークホルダーが理解し、適用するのを支援する目的で作成されたものである。
しかしながらISO/TR 80002-2は難解である。 これでは本末転倒と言わざるを得ない。もっと分かりやすいガイダンスが望まれる。








