第7章 査察からWarning Letterまでのフロー
7.1 FDA査察実施の事前通知
日本の場合、通常2~3ヶ月程度前にFDAから査察の事前通知がされる。過去にわずか3週間前の通知もあったが、大体2ヶ月から3ヶ月前に米国代理人宛に通知が来るのが一般的である。その後、査察の日程調整が行われる。佐塚は海外出張で3社程度の査察を行うのが通常である。医療機器は4日間、医薬品は5日間程度実施され、通常は月曜日から木曜日まで、あるいは月曜日から金曜日までとなる。サイズによって伸びることもある。
事前通知は電子メールで届く。通知には冊の内容が書かれており、候補日が三つ程度提示される。最も都合の良い日、というよりも優先順位をつけて回答することになり、プライオリティワン、ツー、スリーという形で回答する。
この際、どうしても先延ばししたいという理由で最も遅い日付を選ぶ傾向があるが、これは避けるべきである。その週の、特に月曜日の朝とクローズアウトミーティングのある日(木曜日の夕方や金曜日の夕方)に経営者が不在では問題となる。そのため、経営者の予定をよく確認した上で回答する必要がある。決して一番遅い日程を選ぶべきではない。もし回答を送らなかった場合、裁定書が出され強制執行される可能性がある。
FDAは、粗悪品等の米国への輸入を防ぐため、必ず回答を求めている。ホテルの予約や交通手段(Transportation)についての補助も依頼される。回答の送付先も明確に指定される。この担当者は、最初に紹介されたOffice of Complianceの人物であり、決して査察官ではなく査察官のいる事務所の者でもない。FDAの本部のセンター内のOffice of Complianceで、SSMに従って査察を計画している担当者である。



査察実施予定が来た後、査察官が決定したという連絡が再度メールで届く。例えば、具体的な日付や航空機の便名が記載されており、成田空港や関西空港への出迎えが要請される。フライト情報から、どこから来るかが判明する。アメリカからの到着なら1社目である。国内のどこかの駅への出迎え要請の場合は2社目か3社目となる。また、中国からの到着や中国への移動予定なども把握できる。
こういった場合、プラカードを持って到着口まで出迎え、車でホテルまで送ることが慣例となっている。査察官の名前を間違えずに出迎えることが重要で、過去に行き違いで会えなかったケースもある。査察官の名前と携帯電話番号の交換も要請される。
空港からホテル、ホテルから企業までの往復の送迎も依頼される。最初の日の出迎え時間も確認される。査察期間中の連絡先情報や電話番号なども共有される。帰りの便の情報も提供され、次の訪問先も推測できる情報が含まれている。

7.2 遵守していない場合のペナルティ
遵守していない場合のペナルティには段階がある。まず、FDAのForm 483が発行される。これは指摘事項を示すものだが、あくまでも査察官の個人的な見解に過ぎない。その後、実際のFDAの本部から出されるのがWarning Letterである。483で指摘されたことを自主的に改善すれば、Warningは出ないが、483で指摘されたことが改善されなかったり、改善が不十分だった場合は、さらに一歩進んでWarning Letter(警告文書)が発行される。
483は非公開だが、Warning Letterは公開され、ホームページに掲載される。一度掲載されると未来永劫消えることはない。また、Warning Letterで製造工程や設備について言及されてしまうと、競合他社にその情報が知られてしまうリスクがある。そのため、Warning Letterの発行は極力避けるべきである。実は483も終わり方もまだペナルティではない。
ペナルティとしては、ライセンスの一時停止、取消、差し止め、輸出から輸入制限(これはインポートアラートやInput banと呼ばれる)がある。日本企業の場合、日本から輸出する際はこの差し止めや輸出がないため、インポートバンが最も深刻な問題となる。その他、告訴や民事刑事罰等が科される可能性もあり、さらに罰金も課される可能性がある。

7.3 FDA査察結果による判断
FDAはこの査察結果によって、申請の承認をするかしないかを判断する。大きな問題があった場合には申請を保留し、受理をしない、あるいは受理しても審査に入らないといったことがある。また、Warning Letterの発行や、現状のNDAやANDA(変更申請)の却下などの措置が取られる可能性もある。
特に問題が深刻な場合、例えばデータインテグリティの問題があった際などには、その企業に対して何らかの措置が取られる。例えば、未来永劫米国への申請を認めない、リスクの高い製品の米国への輸出を認めないなどの措置が行われることがある。
7.4 FDA査察の評価
NAI(No Action Indicated)は、アクションで決定、つまり措置指示がないことを意味する。指摘事項がないため、483は出されない。これは最も良好な査察結果である。
次に多いのがVAI(Voluntary Action Indicated)である。これは自主的な措置指示であり、指摘はあったものの行政から具体的な措置は示されない。指摘に対して自主的に改善を行えば良く、その改善結果によっては何の措置もなく査察が完了する。
OAI(Official Action Indicated)は、強制措置指示を意味する。重大な指摘があり、行政処置が取られる。少なくともWarning Letterが出される。
7.5 査察フローと結果
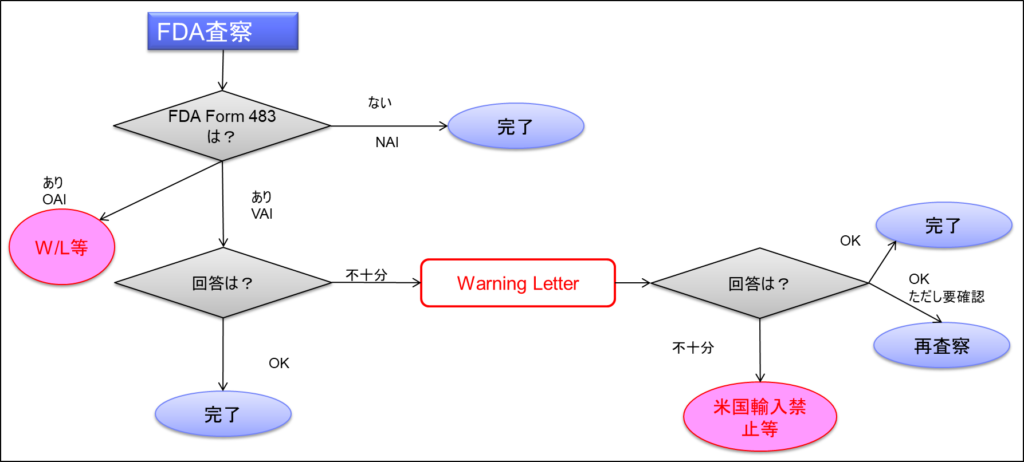
FDA査察が実施され、Form 483がなければNAIで完了となる。ただし、483がなくてもOAIとなる場合があり、この場合は483を書かずに直接FDA本部からWarning Letterが出ることもある。
483が出てOAIの場合は、Warning Letterが必ず出される。Warning Letter(これはDear Letterとも呼ばれる)は、経営者個人に出される。「Dear Mr.」で始まるため、Dear Letterと呼ばれ、会社宛ではなく社長個人名で来る。そしてホームページで公開される。
OAIとなるのは、例えば有害事象の報告漏れ、回収報告漏れ、ミスラベリング、未届けなどの場合である。これらは法律違反であり、GMPや9SRの違反というよりもFDC法違反である場合は、必ずOAIとなり、必ずWarning Letterが発行される。
483があった場合のVAIでは、それに対する回答書を送る。回答というより改善計画書を出し、その計画に従って粛々と改善を進める。通常、半年間ほどかけて改善を毎月報告し、最終的に問題ないと判断されれば完了となる。
この時点でクリアランスレターが送られる。最近はクリアランスレターではなく、EIR(Establishment Inspection Report)が送られてくる。回答が不十分であったり、計画で約束したことが十分に実行されなかった場合は、Warning Letterが発行される。Warning Letterに対してもまたレスポンスレターを出す必要がある。
Warning Letterに対する改善計画を出し、それがOKとなれば粛々と改善を進め、完了となる。しかし、OKであっても要確認のOKがある場合がある。この場合、多くは翌年に再査察が行われる。特に注射剤などの無菌製剤やワクチンなど、リスクの高い製品の場合は再査察となる。ほぼ全ての場合、この時点で合格して初めて一連の査察が完了する。
通常のOKで完了となった場合や、VAIの場合、Warning Letter後の完了の場合も、次回の査察で確認される。ただし、次回の定期査察を待たずに再査察が行われる場合もあり、その場合はほぼ翌年に実施される。
Warning Letterに対する回答が不十分だったり、その後の改善が不十分だった場合は、裁定書による強制執行となる。日本企業の場合は、米国への輸入禁止等の措置(インポートアラートやInput ban)が取られる。
7.6 NAIとEIR
NAIは最も良い成績である。指摘がない場合だが、口頭の指摘は多くの場合存在する。口頭で指摘された事項は記録しておく必要がある。ただし、Form 483は発行されない。この後、Establishment Inspection Report(EIR)が送られてくる。
EIRが来ない場合は請求するべきである。EIRは査察報告書であり、査察官から本部に送られる。査察官は地方事務所に所属しているため、地方事務所から本部に送られるのがこのEIRである。483の指摘があった場合は、483も一緒に送られる。
Office of Complianceの担当者がこのEIRを見て、査察官の指摘を再度レビューする。ここで注意が必要なのは、査察時にNAIとされていても、EIRを見た時点で本部が他の査察との水準合わせのために指摘を追加することがある。場合によってはNAIだったものがVAIに変更されることもある。
そのため、常にFDAの査察のステータスを確認する必要がある。逆のケースもあり、VAIで10個程度の指摘があったものが、半年後にFDAのサイトを確認したところNAIに変更され、指摘がゼロになっていた例もある。
このような変更は半年後くらいにステータスが本部により変更される可能性があるが、その時点まで待てない場合も多い。VAIからNAIに変わった場合は別として、NAIがVAIに変わった場合は対処せざるを得ない。
EIRは非常に詳細な査察報告書であり、過去の査察を経験した方は知っているように、送られてくるものである。送られてこない場合は請求する必要がある。この中には詳細な記録が書かれており、4日間あるいは5日間の査察で1冊を費やすほどの記録が含まれる。
人の名前まで記載され、第三者への質問内容や代理人の回答なども、個人名とともに質疑応答まで記録されている。口頭での指摘事項もメモされており、これらを必ず読んで次回の査察までに対応しておかなければならない。口頭での指摘にも対応が必要である。
EIRが送られてくることで査察が終了となる。VAIの場合、483に対して改善計画書を提出する必要がある。その回答の送付先と回答期限は説明される。送付先はFDAの本部であり、再発鑑定ではない。電子メールか紙の郵便のどちらかを選択する必要があり、両方を選ぶことはできない。
99%のケースで電子メールを選択することが推奨される。紙での送付には多くの問題がある。例えば、郵便局の問題(アメリカの郵便局のストライキやガバメントシャットダウンなど)により期限内に届かないことがある。また、実際に受け取られたかどうかの確認ができない。さらに、少なくとも1週間前に送る必要があるため、改善計画を作成する時間が短くなってしまう。
電子メールであれば、最終日の夕方までに送信すれば、アメリカは時差があるため余裕で到着する。また、受信確認も返ってくるため確実である。レスポンスレターを送り、そこに改善計画を記載し、期限までに実施することを約束する。それを粛々と実行しながら、毎月定期的に進捗を報告し、できれば半年以内に完了させる。
全てが完了したらEIRが送られてくる。EIRが送られてきたら完了となるが、送られてこない場合は催促する必要がある。
7.7 OAIの場合の対応
OAIは強制措置の指示であり、もう即座にWarning Letterが発行される。場合によっては483を発行しないことがある。その場で483を発行せず、後日送ってくることもある。先に説明した通り、査察官は483とEIRをFDA本部に送る。査察官は本部に対して「私はこれをOAIと判断します」と報告を送り、それを見てFDA本部が同意すれば、他社の査察と比較して適切と判断した上でWarning Letterが発行される。
OAIに該当する案件の場合、通常は非常に長い査察が実施される。FDAのコンプライアンスオフィス(Office of Compliance)のレビューを通じて措置が実施されることになる。
7.8 Form 483について
Form 483は既に説明した通り、査察官の文書による個人的な見解である。これは法律で決められており、必ず査察の結果を文書で伝えなければならない。査察官がどのように文書を作成するかというと、査察官のパソコンに483を作成するツールが入っており、そこにフォーマットがあって、指摘事項をコードで探していく。指摘の書き方が査察官によって変わると集計できないため、コードを拾っていくと指摘が出せるようになっている。そのようなツールでForm 483が作成される。
通常、483の指摘は一桁(9つまで)である。多くても9つまでで、10個を超えるとOAIになってしまう。大体1桁で抑えられており、これには関連性があると考えられる。
この483を企業に対して文書で発行するが、パソコンで作成後、査察官によってはポータブルプリンターを持参する人もいる。多くの場合は、USBメモリーや電子メールでPDFを送信してもらい、それを両面コピーするよう指示される。両面という理由は、裏面にディスクレーマーが記載されているためである。必要部数を印刷し、その後で読み合わせを行う。
483は公開されない。ただし、情報公開法に基づいて請求すれば、時間はかかるが他社の483を入手することは可能である。読み合わせはクローズアウトミーティングで行われ、査察官が1つ1つ説明をする。
この際、反論があれば積極的に行うべきである。日本人は一般的に査察官に対して反論をしない傾向があるが、同席するコンサルタントは必ず食い下がる。「なぜそうなのか」「おかしいのではないか」「このような状況である」といった議論は歓迎される。これはアメリカの文化であり、逆に黙っているほうが不気味に感じられる。日本人は一般的に口を閉ざしてしまうが、納得するまで議論をしたほうがよい。また、既に改善したことについても説明したほうがよい。
査察官は多くの施設を見ているため、様々な判断を下すことがある。20分程度で「わかった、あとはFDA本部でやってくれ」と言うこともある。それくらい議論は歓迎される。
もう一つ重要な点は、Form 483は最終的な評価ではなく、FDAのコンプライアンス部門で実施されるということである。483は査察官個人の指摘事項としての報告であると記載されている。先に説明した通り、483とEIRをFDA本部のセンターに送り、Office of Complianceがこの483とEIRを見て最終的なステータスを決定する。
そのため、NAIがVAIになったり、VAIがNAIになったり、場合によってはNAIからWarning Letterに変わることもありうる。このようなことが起こる理由の一つは、査察官が専門外の分野を担当することがあるためである。例えば、無菌製剤について専門知識がない査察官が、現場で聞いた答えについてメモだけして本部に送ったところ、本部がそれはWarning Letter相当だと判断するケースもある。
Form 483のフォーマットには、FDAの住所、査察日時、IDナンバー、会社名、住所、そして指摘事項(オブザベーション1から始まる)が記載される。次のページに2号、3号と続いていく。最終版を作成する際には、FDAの査察官のサインと発行日が入る。電子署名を使用する査察官も稀にいる。
議論の途中で「わかった」となれば、その時点でオブザベーションを確定し、最終版を作成する。あるいは訂正して作成する。最後に署名入りのものが手渡される。それを受け取り、レスポンスレターを作成することになる。
Form 483の最後にリマークがあり、備考欄がある。そこでオブザベーションの説明を受け、ディスカッションをした結果、最終的な回答についてメモされる。例えば、オブザベーション1に対してどうするか、拒否するのか、さらなるディスカッションを求めるのか、改善を約束するのかといったことを聞かれる。
ほとんどの場合、Promise to correct(改善を約束する)というステータスにならざるを得ない。FDAはアメリカにあり遠く、時差もあり、言語の壁もある。そのため、Further discussion(さらなる議論)やReject(拒否)といった選択は危険である。その場でディスカッションして査察官の主張を受け入れ、Correct to promiseというステータスにすることが一般的である。
各オブザベーションについて、このような回答をメモしてもらい、最終的に発行される。483を受け取ったら15営業日以内(アメリカの営業日で計算)にレスポンスをFDAの本部に送らなければならない。是正をコミットし、コミットメントが確実で達成可能であることを確認する必要がある。
決して大風呂敷を広げてはいけない。また、指摘されたことだけを修正・是正するというのは非常にネガティブである。問題を広めに捉えて対応するほうがよく、周辺も含めて改善を約束することが推奨される。
15日という期限は短いため、最初のレスポンスは極めて詳細である必要はない。まずはラフな計画だけ送っておき、15営業日以内に届けばよい。詳細については、その後何回かに分けて送ることができる。次回査察時に改善実施について確認されるため、確実に改善できることを書く必要がある。机上の空論のようなことを書いてはいけない。実現不可能なことを約束して、次回のサービスで約束が守られていないとなると、それこそOAIになってしまう。
レスポンスは査察を実施した査察官宛ではなく、FDA本部に送付することに注意する必要がある。レスポンスには、まずオブザベーションを繰り返し記載し、CAPA(改善計画)を書き、問題を解決あるいは対処するために企業として何を実行するかを記載してレスポンスする。

7.9 Form 484について
Form 484は、査察官がサンプルを持ち帰るときに発行される。これについての経験は私も非常に少ない。サンプルを持ち帰るのは、例えば偽薬が出回ったときなどである。市場で偽薬が発見された場合、Form 483と485によってサンプルが持ち帰られる。
7.10 査察終了後の対応
483の回答が不十分であれば、Warning Letterを受け取ることになる。483にならなかったが他に指摘点があれば、原因の究明と再発防止の手段を講じる必要がある。また、後日FDAより送付されてくるEIR(Establishment Inspection Report)の内容を確認する必要がある。これには483には書かれていない詳しい情報が含まれている。
FDAは2009年8月以降、この回答期限を15日以内とすることを通知した。これは実際には、Warning Letterの発行を15日間猶予するという制度である。つまり、Warning Letterは基本的には出るのだが、15日以内にレスポンスを送れば、Warning Letterの発行を猶予するという仕組みである。
これは2009年、オバマ政権下の民主党政権時に新しい長官が発表したものである。Warning Letter発行前に483への回答をするために15日(15作業日)の猶予を与えることを公表した。そのため、必ず15営業日以内に回答書を届ける必要がある。
もし483で示された問題点の指摘を解決しない場合は、Warning Letterに進むことになる。Warning Letterは、マーケティングや宣伝についての重大な違反行為に対しても発行される。ホームページに掲載されるため、そのような内容も終わり方の対象となる。
Warning Letterを受け取った場合も、15営業日以内に是正計画を提出しなければならない。どうせ実施しなければならないのであれば、483の段階で解決しておくべきである。Warning Letterが出てしまうと企業の信用が失墜し、株価も下がるなど、とんでもないことが起きる可能性がある。
7.11 EIR(Establishment Inspection Report)
EIRについては既に説明したが、その重要性について改めて述べる。NAIだった場合、査察終了から6週間とか2ヶ月で届く。2ヶ月経っても届かない場合は確認すべきである。また、レスポンスレターを送り、全ての改善が終わった後、6週間程度でEIRが送られてくる。何かあれば確認し、催促する必要がある。
EIRは、違反の可能性のある重要な問題と監査事項をまとめたものである。また、コンプライアンス担当者に適切なアクションを取るように推奨しているもの、いわゆるエンドースメントも含まれている。
7.12 最後に
FDA査察の対応において最も重要なことは、問題を正確に把握し、適切な改善計画を立て、確実に実行することである。特に期限(15営業日)の遵守は極めて重要であり、回答の方法(電子メールか紙か)の選択も慎重に行う必要がある。
また、EIRの重要性を認識し、次回査察までにすべての指摘事項(口頭指摘を含む)に対応することが求められる。査察結果のステータス(NAI、VAI、OAI)は変更される可能性があることを念頭に置き、常にFDAのサイトでステータスを確認する習慣を持つことも重要である。
最終的には、FDA査察は単なる規制対応ではなく、企業の品質システムを向上させる機会として捉えることが望ましい。指摘事項への対応を通じて、より強固な品質システムを構築することができれば、それは企業にとって大きな価値となる。