第4章 FDA査察概要
4.1 FDA査察の典型的スケジュール
FDA査察は医薬品の場合は通常5日間、医療機器の場合は4日間にわたって実施される。初日は、まずFDA査察官によるID提示から始まる。これは法律で規定された重要な確認事項であり、必ず実施しなければならない。米国では産業スパイによる偽装査察の事例があるため、このID確認は特に重要視されている。経営者や事業部門長クラスとの名刺交換も行われるが、米国の文化に配慮し、全員が一斉に名刺交換を行うような形式張った対応は避けるべきである。
続いて企業側からプレゼンテーションを行う。ここでは企業の沿革、敷地面積、フロアプラン、従業員数、製造販売製品の種類などの基本情報を説明する。プレゼンテーションは10分程度を目安とし、英語で実施することが求められる。長々とした説明は避け、査察に必要な情報を簡潔に提供することが重要である。
その後、スケジュールの提案が行われる。定期査察の場合、対象となる製品が指定され、製造工程、検査工程、品質保証、文書管理などの順序が提案される。このスケジュールについては、査察官の提案を基本として進められる。
初日の午前中には通常、施設確認訪問が実施される。これは実際の製造現場を見てから監査を行うことで、より具体的な査察を可能にするためである。その後、居室に戻り、午後からは文書と記録の調査が行われる。
FDAの査察には特徴的なポリシーがあり、査察時間の25%をQMS(文書)の調査に、75%を記録の調査に充てることとされている。これは、トップダウン型の査察手法を採用しているFDAの特徴であり、まずSOPの説明を求め、次にそのSOPに従った記録の確認を行うというアプローチを取る。これは記録の調査が9割を占める日本やヨーロッパの査察とは異なる特徴である。
最終日は通常、午後3時頃からクロージングミーティングが開催される。ここでは指摘事項がある場合、FDA Form 483が発行され、その説明が行われる。文書による指摘と口頭による指摘の両方が行われる場合があり、この時点が指摘内容の訂正における最後の機会となる。ディスカッションを通じて483フォームの修正も可能である。また、施設側からのコメントの機会も設けられ、最後に査察官から総括評価が行われて終了となる。

4.2 査察スケジュールに関する重要事項
査察スケジュールに関して重要な点は、査察官が品目を選定する権限を持っているということである。特筆すべきは、査察対象が米国輸出品目に限定されないという点である。これは、企業の品質管理に対する姿勢を総合的に確認することが目的とされているためである。
スケジュールの変更は原則として認められないが、製造所での危険作業実施時など、明確な理由がある場合に限り、時間調整が可能となる。単なる希望や都合による変更は認められない。時間管理については、開始時間が通常午前9時とされており、終了時間は査察官の裁量に委ねられるが、通常は午後5時頃となる。査察にかかる時間について質問することは避けるべきとされている。
4.3 査察開始時の対応と進行
査察開始時には、まず査察の種類と目的を明確にし、査察スケジュールの協議と確認を行う。これらの確認事項は、円滑な査察の実施のために極めて重要である。通常の進行としては、自己紹介および名刺交換から始まり、査察目的の確認、スケジュールの確認、会社概要・製造所概要の紹介、製造方法・製造場所の説明、製造所のツアー実施、文書・記録類の審査、そして問題点の指摘と講評という流れで進められる。
製造所代表者による挨拶では、通常、役員もしくは製造所長が対応し、遠路来訪への謝意を表明するとともに、査察への協力姿勢を示す。ただし、不必要に長い説明は避けるべきである。
4.4 15分ルールと迅速な対応の重要性
FDA査察において非公式ながら極めて重要な「15分ルール」が存在する。これは査察官からの要求に対して15分以内に適切な資料等を提示しなければならないという暗黙のルールである。この対応のために、文書・記録類は査察会場の近くに適切に配置し、迅速な資料検索システムを構築しておく必要がある。15分を超える場合は、提出可能時期を明確に説明し、次の質問への移行を要請するなど、適切な対応が求められる。
4.5 日々の査察対応と記録管理
査察期間中は、毎日の査察終了時にデイリーラップアップミーティングを実施することが推奨される。これにより、その日の指摘事項を確認し、改善可能性を検討するとともに、翌日の準備事項を確認することができる。指摘事項に対しては即時の対応が求められ、可能な限り翌朝までに是正処置を実施することが望ましい。
コミュニケーション管理も重要な要素である。専門的な通訳者を確保し、事前に用語確認を行うとともに、複数通訳者による交代制を採用することで、正確な意図伝達を確保する必要がある。また、全てのやり取りを記録し、要求資料リストの作成、提出文書のコピー保管、指摘事項の詳細記録など、徹底的な記録管理が求められる。
4.6 FDAの査察の特徴的な傾向
FDAの査察には特徴的な傾向がある。それは、ある事象に対して「狭く深く」質問がなされるという点である。これは一般的なコンサルタントによる模擬査察が「広く浅く」行われるのとは対照的である。模擬査察では全ての領域に対して、あらゆる製品やプロセスについて確認を行うため、どうしても広く浅い確認になりがちである。一方、FDA査察官は、ある製品のある特定のプロセスをピンポイントで深く掘り下げて確認を行う。
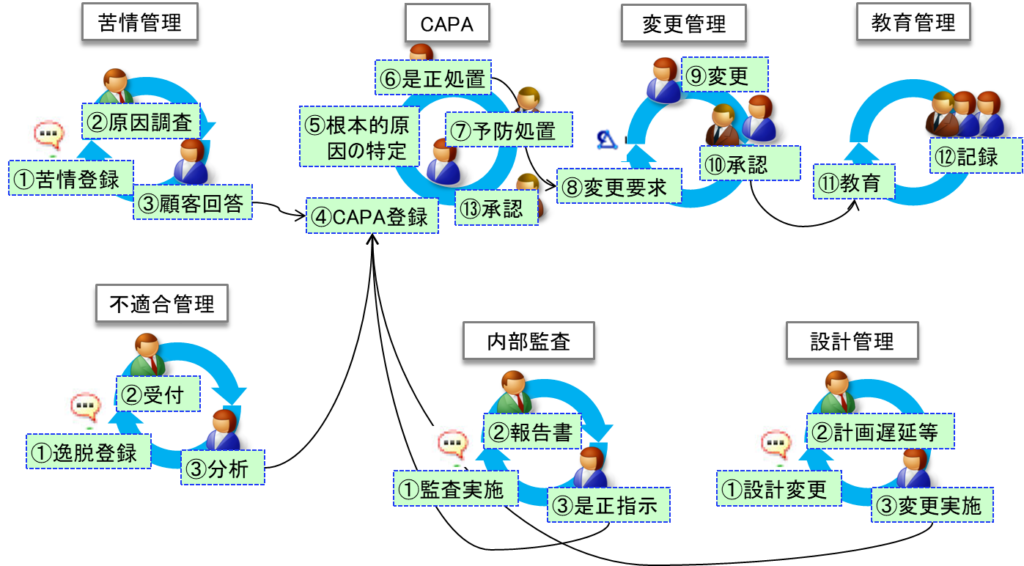
具体例を挙げると、査察はまず苦情一覧表の確認から始まることがある。査察官はその中からQMSに従って約11件を選び、それぞれの苦情について詳細な質問を展開する。例えば、ある顧客からの苦情に対して、いつ苦情を受け付けたか、原因調査はどのように行ったか、有害事象報告の要否をどのように判断したか、顧客への回答内容はどうであったか、CAPAをどのように実施したか、根本的な原因は何であったか、手順書やその他関連資料のどの部分を変更したか、変更後の手順書に関する教育訓練をいつ誰に実施したか、といった具合である。これらの質問が矢継ぎ早に行われる。
このような質問に対して、口頭での回答は認められず、全て資料による証拠での説明が求められる。そのため、情報の連携が極めて重要となる。全ての必要な記録は、苦情、CAPA、変更管理、教育訓練などのイベントごとに紐づけられており、相互に参照可能な状態で管理されている必要がある。

イベント管理における情報の連携は、品質システムの中核を成す重要な要素である。これは複数の品質管理プロセスが相互に関連し合い、一つのイベントが他のプロセスに連鎖的な影響を及ぼすためである。以下に、主要なイベントの連携の流れを詳しく説明する。
まず苦情管理プロセスでは、苦情の登録から始まり、原因調査を経て、顧客への回答までの一連の流れが存在する。この過程で発見された問題は、CAPA(是正処置・予防処置)システムに登録される。CAPAシステムでは、根本的原因の特定、是正処置の実施、予防処置の展開という流れで問題解決が図られる。
このCAPAプロセスの中で、多くの場合、変更管理が必要となる。例えば、手順書の改訂、工程パラメータの変更、設備の改修などである。変更管理プロセスでは、変更要求の提出から始まり、変更の影響評価、実施計画の立案、承認、実施という段階を経る。さらに、これらの変更が実施された後には、必ず関係する従業員への教育訓練が必要となる。
このように、一つの苦情から始まったイベントが、CAPA、変更管理、教育訓練と連鎖的につながっていく。同様のイベントの連鎖は、不適合管理からも始まりうる。例えば製造工程で発見された不適合は、受付、分析、是正処置へと進み、必要に応じてCAPAシステムへと展開される。
また、内部監査の結果から始まるケースもある。監査での指摘事項は是正指示として発行され、これがCAPAシステムに入力される。医療機器企業においては、設計管理からのCAPAというルートも存在する。設計変更や設計上の問題点がCAPAの起点となることがある。
これらのイベントに共通する重要な特徴は、その発生タイミングが予測不可能だということである。苦情はいつ発生するか分からないし、不適合も予期せぬタイミングで発見される可能性がある。そのため、これらのイベント情報は常に追跡可能な状態で管理されていなければならない。
情報の連携においては、あらゆる方向からの参照可能性が求められる。具体的な例を挙げると、まず苦情情報からはその対応として実施されたCAPAを即座に参照できなければならない。そのCAPAから派生して実施された変更管理の情報も直ちに確認できる必要がある。さらに、その変更に関連して実施された教育訓練の記録まで、一連の流れとして追跡可能でなければならない。
同時に、逆方向への追跡も重要である。例えば、ある従業員の教育訓練記録を見たときに、それがどの変更に基づくものであったのかを遡って確認できなければならない。また、その変更がどのCAPAに基づいて実施されたものか、さらにそのCAPAの起点となった苦情や不適合は何であったのかまで、順を追って確認できる必要がある。
このように、全ての品質関連情報が相互に関連付けられ、多方向から参照可能な情報管理システムを構築し維持することが、FDA査察対応において極めて重要となる。なぜなら、査察官からの質問に対して、関連する全ての記録を15分以内に提示できる体制を整えておく必要があるからである。このような包括的な情報管理体制があってこそ、FDAの「狭く深い」査察アプローチに適切に対応することが可能となるのである。
このように、FDA査察への対応では、事前の十分な準備と査察中の適切な対応の両方が不可欠である。査察官との適切なコミュニケーション維持、要求事項への迅速な対応、文書・記録類の適切な管理と提示、改善事項への即時対応、そして正確な記録の保持など、多岐にわたる要素を適切に管理し、計画的に対応することが、成功的な査察の鍵となる。特に、品質システムの運用における情報の連携と管理は、FDAの「狭く深い」査察に対応する上で極めて重要な要素といえる。