
どのような企業がFDA査察の対象となるか
どのような企業がFDA査察の対象となるか
筆者がしばしば質問を受けることの一つに「FDAの定期査察において、どのような企業が対象になるか?」というものがある。
FDAの場合、サイト選択モデル(SSM)を採用している。
FDAはSSMを使用して、リスクベースの要因を使用してカタログ内のすべての施設のスコアを計算する。
- 製品固有のリスク
異なるタイプの製品は、剤形、投与経路、または製品が無菌であることが意図されているかどうかなどの特性に基づいて、レベルのリスクが異なる。たとえば、無菌の注射可能な医薬品を製造する製造施設は、経口カプセルを製造する施設よりも固有の製品リスクが高くなる。 - 施設のタイプ
リスクレベルは、施設が実施する操作によって異なる。医薬品や有効成分を製造する施設は、医薬品のみを包装する施設よりもリスクが高くなる。 - 患者の被ばく
施設が製造する製品が多ければ多いほど、患者はその施設で製造された製品に遭遇する可能性が高い。これは、製造された製品の数と種類の両方を指す。多くの製品を製造する施設は、少数の製品を製造する施設よりも曝露係数が高くなる。 - 査察履歴
以前に査察されたときに確立された品質基準を満たしていない施設は、過去に基準を満たした施設よりもリスクが高いと見なされる。 - 最後の査察からの時間
施設が最後に査察されてからの時間が長くなるにつれて、再査察の必要性と同様に、確立された品質基準を満たさない可能性があるリスクが高まる。 - ハザード・シグナル
製品のリコール(回収)や、施設に関連する品質問題に関する製造業者または患者の報告などのイベントは、主要なハザード・シグナルが少ないかまったくない施設と比較して、リスクスコアが高くなる。
FDAはこのようなサイト選択モデル(SSM)を使用して、どの施設を査察するかを決定しているのである。
FDAにおける、製造所の定期査察は、もともとFDC法で定められており、2年から3年に1回実施するということになっていた。
しかしながら、FDAは査察官の数をあまり増やすことができない。米国内だけでも2、3年に1回では回せなくなってきたのである。それにもかかわらず、サプライチェーンがグローバル化し、日本やヨーロッパをはじめ、中国、インド等、様々な国々の査察をしなければならなくなった。
そのため、FDC法で定められていた、2年から3年に1回の定期査察を実行することができなくなったのである。
そこで、2003年頃にFDC法が改正され、2年から3年に1回ではなく、リスクベースで査察を行うことになった。
その結果、SSMのスコアによって査察対象を選ぶという方式となった。
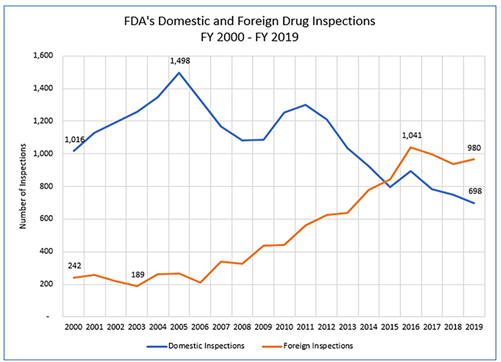
2015年以降、FDAは国内よりも外国の医薬品査察を実施するプログラムに移行した。 米国内ももちろん重要ではあるが、サプライチェーンがグローバル化し、原薬を含め、医薬品を外国から輸入することが多くなった。そのため、外国の企業、海外査察を増やしたのである。
関連商品
ecompliance.co.jp
【書籍】FDA査察対応






