
GMPの3原則
GMPの3原則
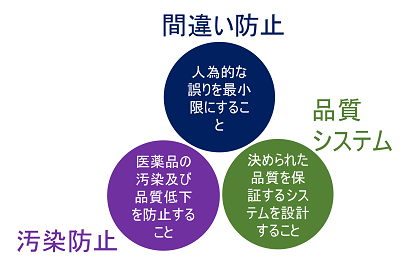
GMPの3原則は下記の通りである。
- 人為的な誤りを最小限にする
- 汚染及び品質低下を防止する
- より高度な品質を保証するシステムを設計する
これらは、よく知られた言葉であるが、実は誰が言い出したのかは分かっていない。規制要件や通知等にも記載はない。我が国にGMPが導入された時にわかりやすく説明するために使用されたようである。
GMPの3原則は国によっても異なる。
例えば、米国FDAでは、
- keep it clean
- check and double check
- write it and down
とされている。
一方でWHO-GMPにおける3原則は、
- 人為的ミスの軽減(ルール、教育訓練)
- 汚染と品質低下防止
- 品質を高めるシステムを構築
である。
これを見ていると、本邦におけるGMPの3原則は、WHOを参考にしたものと推察される。
本邦におけるGMPの3原則の意図するところは、
1. 人為的な誤りを最小限にする
文書による作業の標準化(SOP)、教育訓練など
2.汚染及び品質低下を防止する
交叉汚染防止
洗浄、ラインクリアランス、装置メンテナンスなど
3 より高度な品質を保証するシステムを設計する
逸脱・変更管理、製品品質照査、マネジメントレビュなど
である。
米国FDAが世界で初めてGMPを法制化したのは1963年であった。これは1960年~1962年に発生したサリドマイド事件をきっかけとしている。
1969年には、WHOがGMPを制定し、加盟国に対して医薬品貿易においてGMPに基づく証明制度を採用・実施するよう勧告した。
本邦においては、1974年に当時の厚生省が「医薬品の製造および品質管理に関する基準について」(厚生省薬務局長通知 薬発第801号)において、医薬品製造業者に対してその実施を指導したのが最初である。 おそらくその際にWHO GMPが参照されたものと思われる。








