
EUDAMEDの登録方法は?関連情報まとめ
EUDAMEDは欧州における医療機器データベースです。
EUDAMEDは、EU市場で入手可能な医療機器に関する情報をWebの公開情報で入手可能とすることで、情報の透明性を確保し、適切な調整を実施することを目的としています。
欧州MDRでは、事業者、機器、認証、臨床試験、市販後調査情報、UDI等の様々な情報をEUDAMEDに登録することが求められています。
EUDAMEDは、6つの相互接続されたモジュールを中心に構成され、一般人がアクセス可能なようにWeb上で公開されています。
本ページではEUDAMEDに係る様々な情報を集約し、ご提供いたします。
EUDAMEDへは以下からアクセス可能です。
EUDAMEDの稼働状況
欧州MDRは2021年5月26日に完全施行となりましたが、2021年10月現在、以下のモジュールが稼働しています。
- Actor registration module
- UDI/Devices registration
- Notified Bodies and Certificates
欧州MDRの完全施行日にEUDAMEDが完全に機能していない場合は、EUDAMED稼働に関する通知(官報)が発行された6ヶ月後にEUDAMEDに関する規則が適用されることとなっています。(欧州MDR Article34およびArticle123(d))
また、UDI および認証書のEUDAMED登録は、EUDAMEDが完全稼働した日から18ヶ月後に適用とされています(欧州MDR Article 123(e))
なお、EUDAMEDが完全に稼働するまでの間の取り扱いについて「MDCG 2021-1「Guidance on harmonised administrative practices and alternative technical solutions until EUDAMED is fully functional(EUDAMEDが完全に機能するまでの、調和のとれた管理慣行と代替技術ソリューションに関するガイダンス)」が発出されています。
MDRの条文においてUDAMEDへの登録を義務付けられている事項について、EUDAMEDが稼働するまでの間の対応方法を示したガイダンスです。
MDCG2021-1の邦訳はこちらをご参照ください。
Actor registration module
経済事業者(Economic Operators / 製造業者、欧州代理人、輸入業者、PRRC等)を登録するモジュールです。
2020年12月に稼働を開始しました。
Actor registration moduleへの登録
1. EUアカウント登録
① EUDAMEDのWelcomeページにアクセスします。
②「Enter with EU Login」をクリックします。

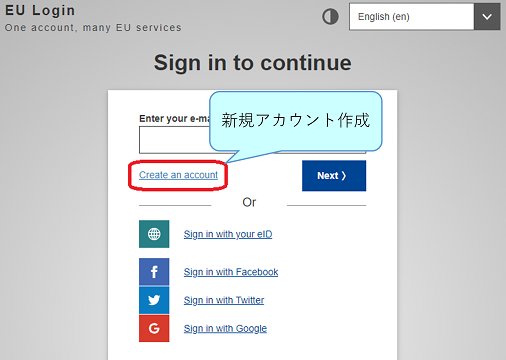
③ログインページに遷移するので、下図赤枠から新規アカウントを作成します。
2. Actor 登録
① 作成したアカウントでログインし、「ACTOR REGISTRATION」をクリックします。

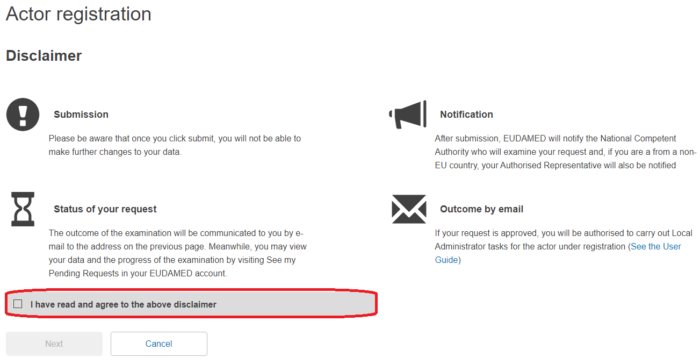
②Disclamerを確認し、チェックボックスにチェックを入れ、「Next」をクリックします。
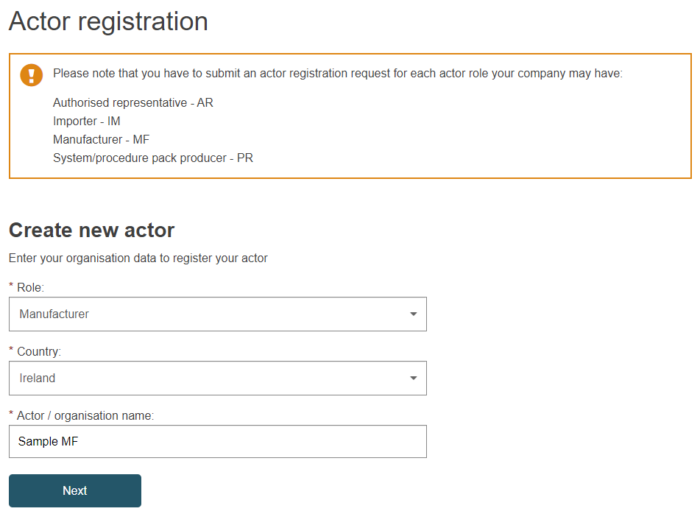
③画面表示に従って、必要事項を入力していきます。合計6つの入力ステップがあります。
④2ステップ目で、欧州代理人(Authorised Representative)の情報の入力が求められます。
EU域外の製造業者の場合、欧州代理人が先にEUDAMEDに登録されている必要があることにご留意ください。
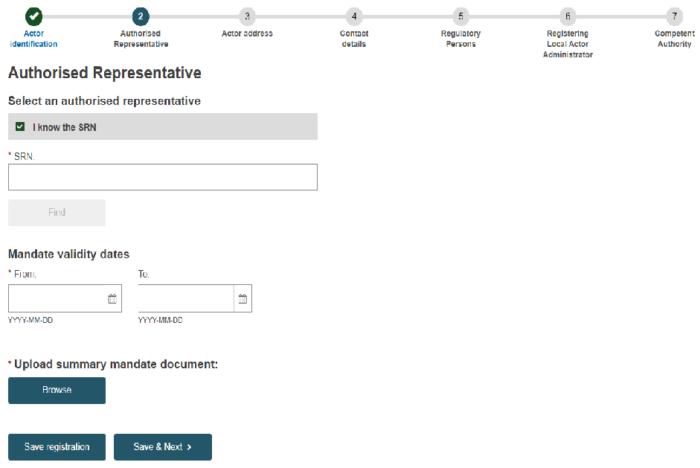
「Save & Next」をクリックします。
引き続き、必要情報を入力していきます。
⑤入力を終え、情報をsubmitするとconfirmationページに遷移します。
ページの内容を確認後、「Confirm」をクリックします。
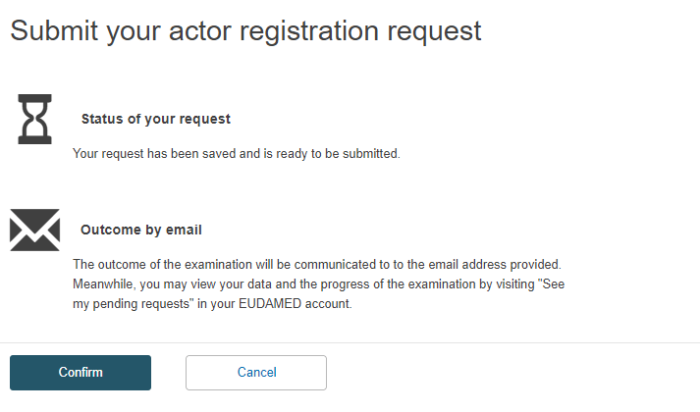
⑥欧州代理人が情報を確認(Verify)します。
⑦関連する当局(Competent Authority)による情報のバリデート後、Actor登録が完了します。
関連資料
| Guide to use EUDAMED Actor registration module for economic operators | Actor登録の手順を解説した文書です。 |
| Actor登録リクエストプロセス | Actor登録リクエストプロセスの図解資料です。 |
| Actor moduleに関するFAQ | Actor moduleに関するFAQをまとめた資料です。 |
関連ガイダンス文書
| MDCG 2021-13 | MDR第31条およびIVDR第28条の対象となる製造業者、欧州代理人および輸入業者以外の関係者のEUDAMEDへの登録に関する義務および関連規則に関する質問と回答 (Questions and answers on obligations and related rules for the registration in EUDAMED of actors other than manufacturers, authorised representatives and importers subject to the obligations of Article 31 MDR and Article 28 IVDR) |
経済事業者(Economic Operators)の検索
Actor registrationモジュールで登録された情報は一般に公開されます。
以下から登録情報を検索・閲覧することが可能です。
UDI/Devices registration
2021年10月に稼働を開始しました。
2021年10月時点で、登録はVoluntaryです。
Notified Bodies and Certificates
2021年10月に稼働を開始しました。
2021年10月時点で、登録はVoluntaryです。
Clinical Investigations and performance studies
未稼働のモジュールです。
Vigilance and post-market surveillance
未稼働のモジュールです。
Market Surveillance
未稼働のモジュールです。
