設計変更とは
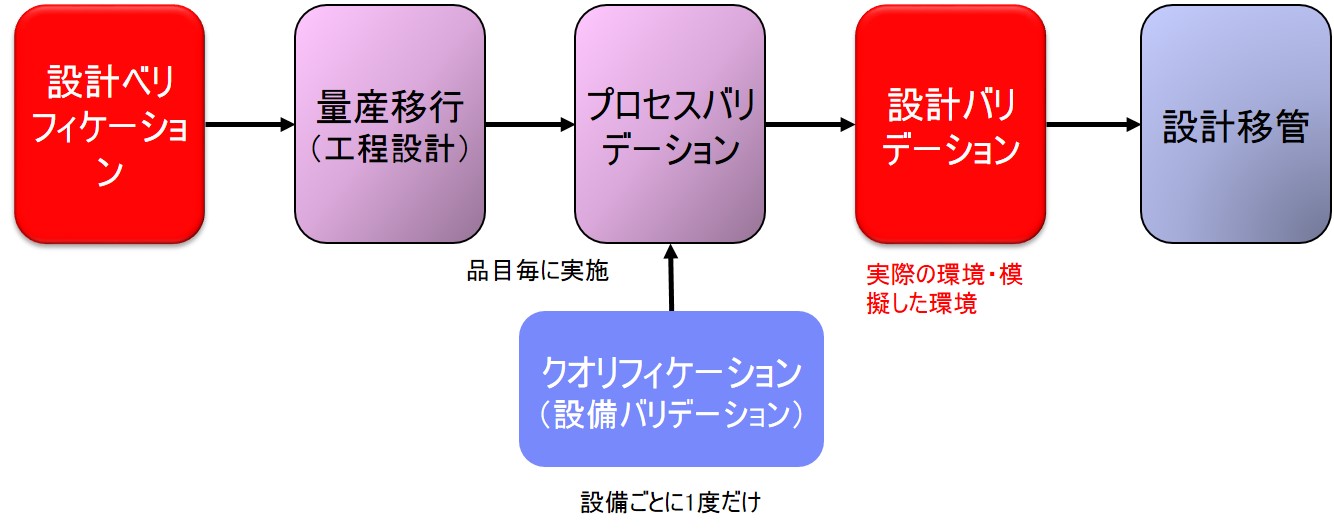
設計バリデーションは「FDA 21CRF Part820 Quality System Regulation」の「Subpart C§820.30(g) Design validation」で規定されている。
| (g) 設計の妥当性確認各製造業者は、手順を確立し維持し、設計の妥当性確認をすること。設計の妥当性確認は、定義さ れた運用手順の下で、初期製造のユニット、ロット、またはバッチまたはそれと同様な対象に対し て行う。 設計の妥当性確認は、機器が定義された使用者のニーズおよび意図された用途に適合する ことを保証し、実際のまたは模擬した使用条件下での製造ユニットの試験を含むこと。 設計の妥当 性確認は、適切な場合はソフトウェアの妥当性確認および危険分析を含むこと。設計の妥当性確認 の結果、例えば設計方法、日付および妥当性確認をした者(一人または複数)を特定するものを設 計履歴ファイル(DHF)に文書化すること。 |
- 参考
21 CFR Part820 Quality System Regulation, FDA 1997
Design Control Guidance For Medical Device Manufacturers, FDA 11 March,1997
FDA査察対応設計管理手順書サンプル
イーコンプライアンスでは、FDAが要求する設計管理に対応した、規程、手順書、様式のサンプルを販売しています。
ぜひご購入をご検討下さい。