
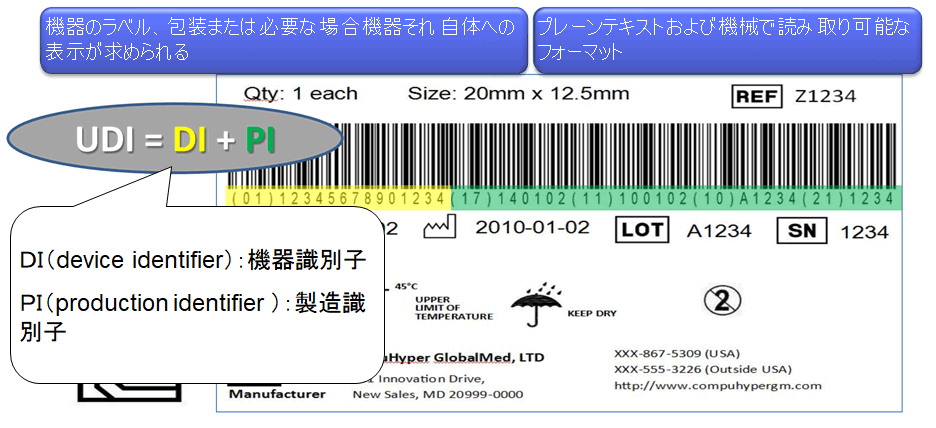
UDI(個体識別、Unique Device Identification)
UDIとは
- UDI:Unique Device Identifier(機器固有識別子)
機器の流通や使用をとおして適切に機器を識別する識別子のことをいう。UDI は以下のものからなる:- 機器の識別子(a device identifier)—UDI の義務かつ定められた部分であり機器の特定のバージョンまたはモデルおよび当該機器のラベラーを特定するもの
- 製造識別子(a production identifier)—UDI の条件付きの、可変の部分であり、機器のラベルに含められた場合に以下のうちの 1 つ以上を特定するもの
- 機器が製造されたロットまたはバッチ
- 特定の機器のシリアルナンバー
- 特定の機器の有効期限
- 特定の機器が製造された日付
- 機器として規制を受ける HCT/P ついては、この章の 1271.290(c)で要求される個別の識別コード
- 2013年9月に制定されたFDAのラベリングに関する新規則
- 2014年9月より段階的に導入開始
UDI規制の目的
- 流通・使用の間に機器を適切に特定できるシステムの確立
- 迅速かつ正確な機器の特定を容易にする
- 機器に関する重要な情報へのアクセスを可能にする
- 電子的なヘルスレコード、クリニカルインフォメーションシステム、レセプトデータソースおよびレジストリに機器の使用を文書化するための 標準的でかつ明確な方法を提供する
UDI規制対応タイムライン
UDI要求のCompliance Dates
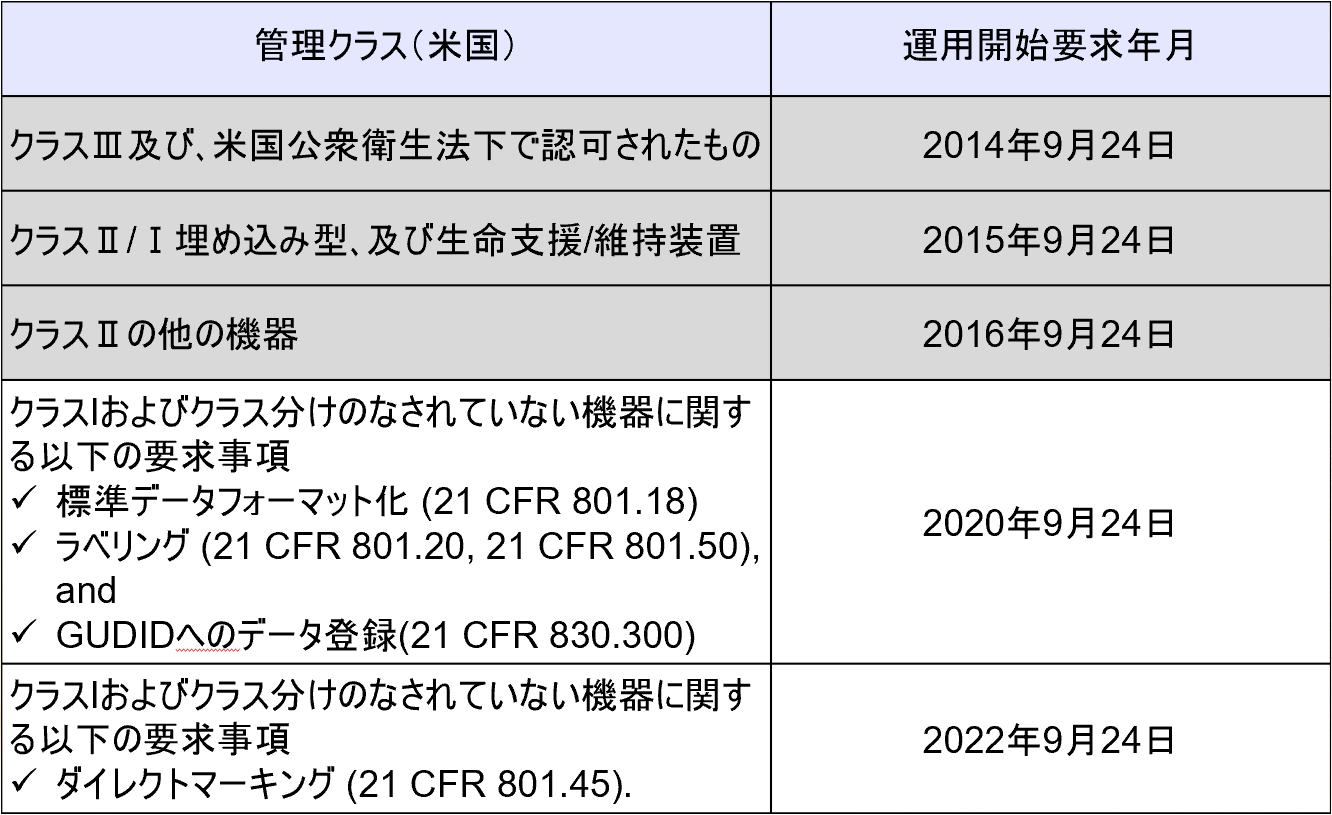
2013年9月24日にFDAはUDIに関するFinal Ruleを発出した。
以下にUDI要求のCompliance Datesを記載する。
| Complianece Date | 要求事項 |
| 2014年9月24日 | ClassⅢ機器のラベルおよびパッケージ、ならびにPublic Health Service Act(PHS Act)により認可された機器はUDIを備えなければならない。§801.20 これらの機器のラベル上の日付表示は§801.18の要求に従った形式でなければならない。 これらの機器のデータはGUDIDデータベースに登録されなければならない。§830.300 規制適応日の1年の延長が§801.55に従ってリクエストされるかもしれない。このようなリクエストは2014年6月23日までに提出されなければならない。 ClassⅢのスタンドアローンソフトウェアは§801.50(b)の要求に従ってUDIを備えなければならない。 |
| 2015年9月24日 | 埋め込み型機器、life-supporting機器およびlife-sustaining機器のラベルおよびパッケージはUDIを備えなければならない。§801.20 これらの機器のラベル上の日付表示は§801.18の要求に従った形式でなければならない。 UDIラベル表示の求められるlife-supporting機器またはlife-sustaining機器である医療機器は、複数回使用し、各使用の前に再処理を行う場合、機器それ自体に永久的な印としてのUDIを備えなければならない。§801.45 life-supporting機器またはlife-sustaining機器のスタンドアローンソフトウェアは§801.50(b)の要求に従ってUDIを備えなければならない。 UDIラベル表示の求められる埋め込み型機器、life-supporting機器およびlife-sustaining機器のデータはGUDIDデータベースに登録されなければならない。§830.300 |
| 2016年9月24日 | UDIラベル表示の求められるClassⅢ機器は、複数回使用し、各使用の前に再処理を行う場合、機器それ自体に永久的な印としてのUDIを備えなければならない。§801.45 ClassⅡ機器のラベルおよびパッケージはUDIを備えなければならない。§801.20 これらの機器のラベル上の日付表示は§801.18の要求に従った形式でなければならない。 ClassⅡのスタンドアローンソフトウェアは§801.50(b)の要求に従ってUDIを備えなければならない。 UDIラベル表示の求められるClassⅡ機器のデータはGUDIDデータベースに登録されなければならない。§830.300 |
| 2018年9月24日 | UDIラベル表示の求められるClassⅡ機器は、複数回使用し、各使用の前に再処理を行う場合、機器それ自体に永久的な印としてのUDIを備えなければならない。§801.45 ClassⅠ機器およびClassⅠ、Ⅱ、Ⅲのいずれにも分類されていない機器のラベルおよびパッケージはUDIを備えなければならない。§801.20 UDIラベリング要求の対象外とされていた機器を含む全ての機器のラベル上の日付表示は§801.18の要求に従った形式でなければならない。 UDIラベル表示の求められるClassⅠ機器およびClassⅠ、Ⅱ、Ⅲのいずれにも分類されていない機器のデータはGUDIDデータベースに登録されなければならない。§830.300 ClassⅠのスタンドアローンソフトウェアは§801.50(b)の要求に従ってUDIを備えなければならない。 |
| 2020年9月24日 | UDIラベル表示の求められるClassⅠ機器およびClassⅠ、Ⅱ、Ⅲのいずれにも分類されていない機器は、複数回使用し、各使用の前に再処理を行う場合、機器それ自体に永久的な印としてのUDIを備えなければならない。§801.45 |
出典:Unique Device Identification (UDI)
UDIに関するラベリング要求事項
21 CFR Part 801 Subpart B – UDIに関するラベリング要求事項




