第9章 内部監査と改善
9.1 自己点検(Self Inspection)について
自己点検は、英語ではSelf Inspectionと呼ばれる。 これまでの日本の製薬・医療機器業界では、指摘の指摘に従って改善していれば許可が与えられてきた。そのため、主観の査察(Authority Inspection)に依存するのではなく、自社の監査(Self Inspection)によってリスクを許容可能なレベルまで低減していく必要がある。
自己検査は、内部監査、外部監査、定期レビュー、マネージメントレビューなど、様々な要素から分かれています。ここで重要なのは、査察官の関心が問題の解決方法ではなく、残存するリスクの本人に向けてしているという点である。
9.2 PIC/S GMP Self Inspection(自己点検)の要件
自己点検の基本原則として、GMP原則の実施及び適合状況を監視し、必要な是正措置を提案するための実行が求められる。品質管理、医薬品の配送、苦情及び回収の手はずなど、すべての要素について、品質保証の原則への適合性を検証する必要がある。されなければならない。
自己を点検実施する際は、独立性と詳細な方法論が重要である。 社内で指定された、能力と権限を持つ者が実施することが求められる。有用とされている。
すべての自己点検は必ず記録に残さなくてもいい。報告書には、点検中に発見されたすべての指摘事項と、必要な場合には是正措置についての提案を含める必要がある。された措置についても記録することが求められる。
9.3 FDA QSR 820.22における品質監査の要件
FDAのQSR(Quality System Regulation)では、各製造業者に対して品質監査の手順確立を求めている。その目的は、品質システムが確立された要求事項に適合していることを確実にし、さらに品質システムの有効性を判定することにある。
品質監査を実施する際の重要な要件として、監査される事項に直接の責任を持たない者によって実施されることが挙げられる。また、必要に応じて不適合事項の再監査を含む是正処置を講じることも求められている。
毎回の品質監査の結果は報告書として文書化し、再監査がある場合はその結果も含めて記録しなければならない。これらの報告書は、監査された事項に責任を持つ管理者によってレビューされる必要がある。また、監査及び再監査を実施した日付と結果についても、確実に文書化することが求められている。
9.4 品質マネジメントシステムにおける監査の目的
監査の主要な目的は二つある。一つは自社のQMS(品質管理システム)が規制要件に適合していることを確認することである。これらの目的は相互に関連しており、どちらも同等に重要である。
9.5 ISO-13485:2016における内部監査の要求事項
ISO-13485:2016では、組織に対して計画的な警備での内部監査の実施を求めている。この監査では、品質マネジメントシステムが以下の要件を満たしていることを確認する必要がある。
まず、品質管理システムが計画し文書化された決定に適合しているか、国際規格の要求事項に適合しているか、組織が決めた要求事項に適合しているか、さらに適用される規制要求事項に次に、品質マネジメントシステムが効果的に実施され、維持されるかを確認する。
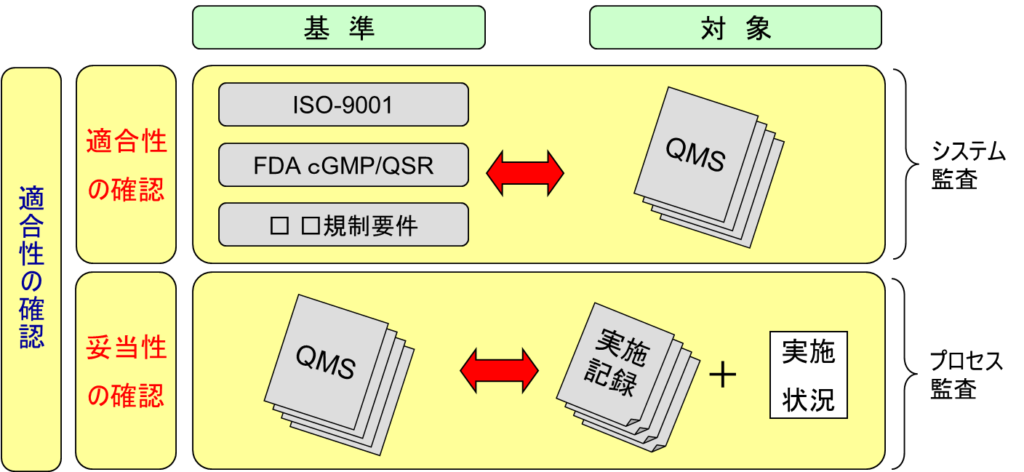
9.6 システム監査とプロセス監査の違い
監査には大きく分けてシステム監査とプロセス監査の二つの側面がある。システム監査では、ISO-9001やFDA cGMP/QSRなどの規制要件への適合性を確認し、品質管理の仕組みが法規制に一方、プロセス監査では実際の実施状況を確認し、正しいQMSのもとで品質管理システムが正確に履行される品質を保証する。
これらの監査活動、QMSは組織の品質保証活動に根拠を与え、品質保証システムを確立する基盤となる。
9.7 監査担当者に求められる資質と要件
監査担当者には高度な資質が求められる。まず、物事を第三者的な視点で観察し、論理的に矛盾点や問題点、課題点を抽出できる能力が必要である。さらに、それらの原因を究明し、適切な解決策を提示できなければならない。
また、深いスキル、鋭い洞察力、十分な経験といった力量も不可欠である。さらに、経営者から適切な権限を与えられ、品質保証が機能しているか、QMSが有効に働いているかを監査する立場にある必要がある。組織としては、経営者直轄の組織として位置づけられることが望ましいとされている。

9.8 監査員の力量の定義と重要性
ISO19011:2011では、監査員の力量を「意図した結果を達成するために知識及び技能を適用する能力」と定義している。監査員には、単なる知識や技能だけでなく、監査員としてふさわしい振る舞いや態度も求められる。特に、良好なコミュニケーションを取るための行動が重要である。
例えば、相手の話をよく聴かない、自説に固執する、すぐに感情的になるといった態度は、マネジメントシステムの正確な把握や、被監査者への指摘事項の理解促進を妨げる要因となる。このような態度は、内部監査に対する信頼感を低下させる最大の要因となり得る。
9.9 監査で発見された指摘事項への対応プロセス
監査で問題点が発見された場合、その対応は単に表面的な問題解決にとどまってはいけない。まず、なぜその問題が発生したのかを深く考察する必要がある。次に、同種の問題が他の箇所でも発生していないかを調査し、業務の質や機器への影響を総合的に検討する。
これらの分析に基づいて、問題の再発を防止するための具体的な対策を立案し、改善計画として実行に移す。さらに、改善の効果を確認するためのフォローアップ監査も実施する必要がある。
9.10 内部監査における是正処置の実施
内部監査で不適合が発見された場合、その是正処置は被監査部門の責任者が実施する。まず内部監査員が不適合事項を発見して被監査部門に報告し、その報告を受けた被監査部門の責任者が具体的な是正処置を実施するという流れになる。
不適合およびその原因の除去は、遅滞なく実施されることが重要である。具体的には、まず指摘された不適合がなぜ発生したのかの根本的な原因を調査・特定する。ここでは表面的な原因ではなく、真の原因(根本的原因)を究明することが求められる。
次に、発見された不適合を除去するための修正処置を実施し、特定された根本的原因を除去して再発を防止する。これら一連のプロセスについては、すべて記録として残す必要がある。
9.11 CAPAにおけるFDA対応の重要ポイント
CAPAはFDA査察において最も頻繁に指摘される項目の一つであり、品質システムの中で最も重要な要素とされている。そのため、FDA査察への準備において最も注力すべきポイントといえる。
近年では、CAPAシステムの構築はほぼ標準的な要件となっているが、それでもなお最も多くのFDA Form 483(指摘事項)が出される領域となっている。日本企業では、CAPAの管理にNotes、Excel、紙ベースなどを使用していることが多いのが現状である。
FDAのCAPA要求の特徴として、是正処置(Corrective Action)を実施した場合には、原則として予防処置(Preventive Action)も実施することが求められる。一部の企業では是正処置と予防処置を分離して管理しているが、これはFDAの査察官から指摘を受ける可能性があるため注意が必要である。
CAPAシステムの運用では、多くのプロセスと関連付けてあらゆる品質情報を取り入れ、包括的に対処することが重要である。一部の企業ではCAPAへのインプットを顧客苦情のみに限定しているが、これは不十分である。CAPAは単なる苦情管理ではないということを理解する必要がある。
品質に関する欠陥や誤り、不調の原因を取り除く処置と、不適合の再発防止のための効率的でシステマティックな処置を構築することが求められる。CAPAを適切に導入することで、企業における不適合の発生率を確実に減少させることができる。
9.12 CAPA(Corrective Action and Preventive Action)の基本概念
CAPAは、不具合の再発防止・未然防止のための標準的な手法である。これは大きく分けて、是正処置(Corrective Action)と予防処置(Preventive Action)の二つの要素から構成されている。
是正処置は、同じ場所で同じ問題が再発することを防止するための取り組みである。ここで重要なのは、修正(Correction)と是正(Corrective Action)は異なるという点である。ISO 9000:2015では、是正処置を「不適合の原因を除去し、再発を防止するための処置」と定義している。
一方、修正はISO 9000:2015において「検出された不適合を除去するための処置」と定義されている。修正は不適合の根本的原因を除去するのではなく、不適合そのもの(直接的原因)のみを除去する処置である。そのため、一般的に修正は応急処置・暫定処置または当面の処置として扱われ、是正処置の一部として位置づけられる。
予防処置は、ISO 9000:2015において「起こり得る不適合またはその他の起こり得る望ましくない状況の原因を除去するための処置」と定義されている。これは未然防止・先手管理、すなわちまだ問題が起きていない場所で予測して防止する取り組みを指す。ここで注意すべき点として、単なる水平展開は予防処置とはみなされないということがある。
ISO-9001:2015では、「予防処置」という用語が箇条から削除された。これは、予防処置が「起こりえる不適合」の未然防止を指し、「起こりえる不適合」は「リスク」と同義であるため、予防処置はすなわちリスク管理であるという考え方に基づいている。そのため、ISO-9001:2015では代わりに「リスクおよび機会」という概念と「リスクベース思考」という概念が強調されている。
実際の運用において、応急処置→修正処置→是正処置→予防処置という流れで対応を進めることが一般的である。例えば、飲酒運転による事故の場合、まず運転手等のけがの手当てをし、安全標識を立てるといった応急処置を行う。次に事故車を路肩に移動させるという修正処置を実施し、その後、運転手の免許をはく奪するという是正処置を講じる。さらに、危険運転致死傷罪を新設するといった予防処置まで実施する。
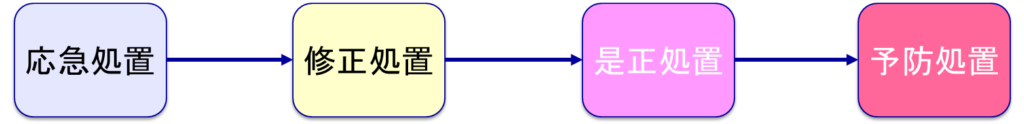
なお、状況によっては是正処置がなく予防処置のみが発生するケースもある。これは主に、根本的原因が見つからない場合や、統計的手法によって起こり得る不適合を予測した場合などで発生する。
9.13 ボーイング787型機の事例に見る予防処置の重要性
2013年4月28日の朝日新聞は、全日空(ANA)がボーイング787型機の運航再開に向けた取り組みについて報じている。この事例は、予防処置の重要性を示す典型的なケースとして注目に値する。
全日空は国内で初めての試験飛行を実施し、改修を終えたバッテリーの確認を行った。2時間の飛行で問題は見られず、伊東信一郎会長は6月1日からの定期便投入への意欲を表明している。
事の発端は、2013年1月に全日空機のバッテリーから発煙し、緊急着陸を余儀なくされた事故である。この事故をきっかけに、同型機は世界中で運航が停止されることとなった。注目すべき点は、この時点でも事故の原因は特定できていなかったということである。
しかし、米国当局は予防的な観点から対策を講じた。バッテリーに多層的な安全装置を施すことで改修を行い、大事故の発生を防止できるとの判断から運航再開を許可した。日本の国土交通省もこの判断を追認する形となった。
ボーイング社の対応も予防処置の観点から注目に値する。同社はバッテリーの耐熱性を高め、排煙機能付きの容器に収めるという改良を実施した。これにより、仮に煙が発生しても機内に充満しない仕組みを構築したのである。この事例は、原因が特定できない状況でも、予測されるリスクに対して適切な予防処置を講じることの重要性を示している。
日本航空も同様の対応を進め、6月の運航再開を目指して試験飛行の準備を進めることとなった。

9.14 是正処置の考え方と実施における重要ポイント
是正処置を実施する際には、個人的なものや製品単独の対応に留まってはならない。そのような限定的な対応では、問題が再発する可能性が高くなってしまう。重要なのは、組織のノウハウとしてシステムに組み込み、再発防止を図ることである。
例えば、ある担当者が深く理解して確実に実施するという対応は、その時点では再発防止として機能するかもしれない。しかし、その担当者が異動したり、別の要員に交代したりした場合、再発のリスクが高まってしまう。
同様に、ある製品で発生した問題を会議で発表し、水平展開を図って再発防止としても、時間の経過とともに効果が薄れ、再発する可能性がある。こうした一時的な対応ではなく、再発を防止するためのチェック機能を仕組み(システム)として確立することが重要である。また、ノウハウをデータベース化して組織全体で活用できるようにすることも有効な方策である。
是正処置と予防処置は、「どの視点から見るか」によって、その性質が変わることがある。例えば、ある人が犯した誤りに対する対策は、その本人にとっては是正処置となるが、その情報を活用する他の人にとっては予防処置として機能する。このように、個人レベルと組織レベルで異なる意味を持つことを理解しておく必要がある。
最も重要なのは、顧客苦情、不適合、ミス、ロスなどを未然に防ぐための仕組み(システム)を確実に構築することである。これらを組織の品質システムに組み込むことで、持続的な改善が可能となる。
9.15 是正処置における教育訓練の位置づけ
よく見られる対応として「このような事故が二度と起きないよう、安全管理を徹底させます」という宣言がある。しかし、このような周知徹底や教育訓練だけでは、本質的な是正処置とはならない。より適切なアプローチは「こういうことがないようなシステムに直して、再発防止を徹底していきます」という方針である。
FDAは約10年前から、教育訓練を是正処置として位置づけることに対して指摘を行っている。その理由は明確である。人間は必ず間違いを起こす存在だからである。例えば、ある従業員が問題を起こし、厳しく叱責されて再教育を徹底的に受けたとしても、その人は懲りて二度と同じ間違いを起こさないかもしれない。しかし、その人が異動して別の人がその業務を引き継いだ場合、また同じ間違いが発生する可能性が高いのである。
つまり、教育訓練は根本的原因の除去にはならず、是正処置としても不十分なのである。これはFDAが10年以上前から指摘している重要なポイントである。問題の本質は必ず品質システムにある。そのため、人は間違うという前提のもと、品質システムの中でチェック機能を確立する必要がある。
具体的には、ダブルチェック、読み合わせ、コンピュータによる入力チェック、バーコードによる読み取りなど、システム的な対策を講じることが求められる。このように、根本的原因を個人の規律や教育訓練、製品固有の問題に帰結させるのではなく、システムレベルでの対応を図ることが重要である。

9.16 不適合発生の原因分析
不適合の発生原因を理解する際、主に四つの観点からの分析が重要となる。まず一つ目は、ルールが作られていないことに起因するケースである。二つ目は、ルールは存在するものの、それを守るべき人に適切に知らされていないことに起因する場合である。三つ目は、ルールが関係者に知らされているにもかかわらず、守るべき人が実際には守っていないことに起因するケースである。そして四つ目は、ルールそのものに不具合を起こしやすい欠陥が含まれていることに起因する場合である。
これらの原因の発生頻度を分析すると、興味深い傾向が見えてくる。全体の約20%が、一つ目または二つ目、つまりルールが存在しないか、あるいは関係者に適切に伝達されていないことに起因している。最も多いのが三つ目のケースで、全体の約80%を占めている。これは、ルールは存在し、関係者にも知らされているにもかかわらず、実際の運用面で問題が発生しているということを示している。四つ目のケース、すなわちルール自体に欠陥があるというケースは比較的まれである。
9.17 不適合発生の原因分析フロー
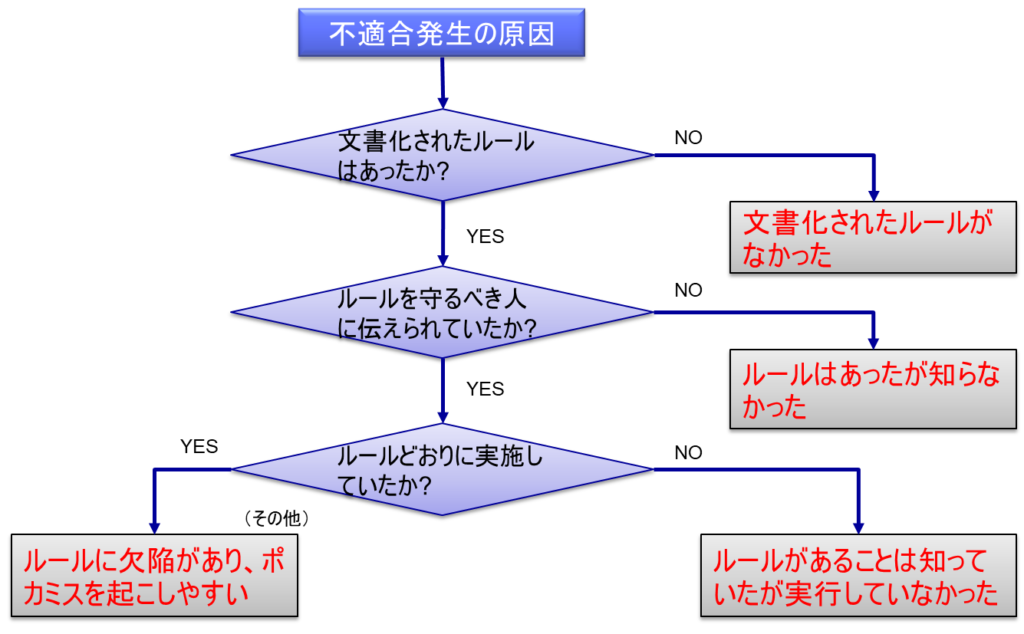
不適合が発生した際の原因分析は、系統的なフローに従って実施することが重要である。まず最初のステップとして、その不適合に関連する文書化されたルールが存在するかどうかを確認する。もしルールが存在しない場合、それ自体が重要な原因として特定される。
ルールが存在する場合は、次のステップとして、そのルールが関係者に適切に伝達されていたかどうかを確認する。もし伝達が不十分であった場合、それが原因として特定される。
ルールの存在と伝達が確認できた場合は、第三のステップとして、実際にそのルール通りに作業が実施されていたかどうかを確認する。この段階で、ルールは知っていたものの実行されていなかったという事実が判明することがある。
最後に、ルールそのものに欠陥があり、作業者がミスを起こしやすい状況が作られていなかったかを確認する。これは比較的まれなケースですが、重要な確認事項となる。
このような段階的な分析を行うことで、不適合の真の原因を特定し、適切な対策を講じることが可能となる。
9.18 根本的原因(Root Cause)の特定
不適合が発生した際に最も重要なのは、なぜそのような事態が引き起こされたのかという根本的な原因を見極めることである。ここでは特に、システム(仕組み)的な欠陥、弱点、不備、矛盾、曖昧さを追求することが重要である。
是正処置(再発防止)の核心は、このようなシステム的な問題点に対して適切に対処することにある。ここで注意すべきなのは、人の規律、注意力、自覚などの人為的要素を是正処置とすることは適切でないということである。その理由は人間の本質に関係している。人間は本質的に怠惰・怠慢な傾向があり、規律や注意力に依存するシステムでは、同じクオリティを持続的に維持することが困難だからである。いつかは誰か(本人も含めて)が同じような問題を再発させてしまう可能性が高いのである。
このため、「教育訓練を徹底させた」というような対応を是正処置として位置づけることは適切ではない。より本質的なシステムレベルでの対応が必要となる。
真の根本的原因を追求する際は、表層的な原因との区別が重要である。例えば、「教育訓練が不足していた」「理解(認識)が不足していた」「〜と思っていた」「〜ができていなかった」といった事項は、確かに原因の一つではあるが、根本的原因とは言えない。これらはより深い問題の表層的な現れに過ぎないのである。
根本的原因の追求では、なぜそのような状況が発生したのか、より深い層まで掘り下げて考察することが求められる。この過程で、組織の仕組みや体制、コミュニケーションの方法、品質管理システムの構造など、より本質的な問題点が明らかになることが多いのである。
このように、不適合の原因分析と是正処置の実施においては、表層的な対応に留まることなく、システムレベルでの本質的な改善を目指すことが重要である。それによって初めて、真の意味での再発防止が実現できるのである。