第10章 品質システムとは
10.1 品質システムとは
医薬品企業・医療機器企業がグローバル化を促進する中、FDAをはじめ海外の規制当局の査察を受ける機会が多くなっている。一方で規制当局は、サプライチェーンがグローバル化していることに伴い、海外査察の回数を増やしている。
しかしながら、査察にかけることができるリソースは限られているため、効率的な査察手法が必要である。従来の査察では、査察官から指摘された事項を是正しておけば、容認されてきた。しかしながら、わずか数日の査察(日本においては4日間)で査察官が発見することができる問題点・リスクは数が限られている。したがって、査察官が発見したエラー(リスク)に対して是正を行えば自国民の安全が守られるということにはならない。
そこでFDAなどの査察では、エラー(リスク)を発見する査察手法から、当該企業が経営者のガバナンス(統治)のもと『品質システム(Quality System)』を確立しているかどうかを調査するといった手法に切り替えている。
10.2 品質システムの構成とプロセス
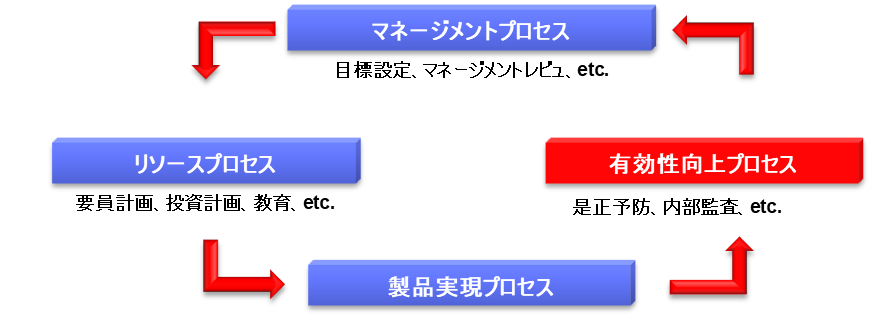
品質システム(QS)は4つのPDCAサイクルで構成される。
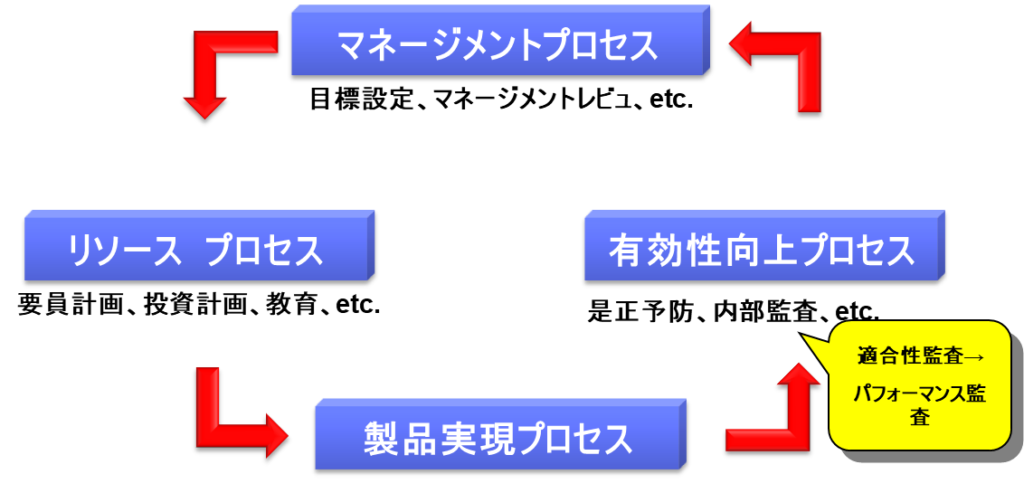
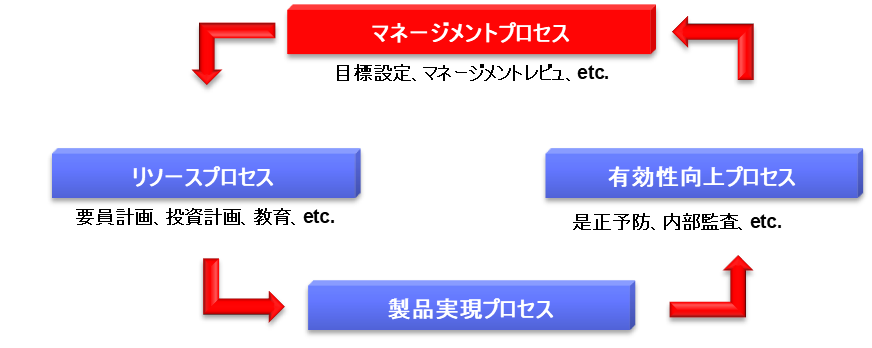
まずマネージメントプロセスでは、経営者が品質方針を作成し、年度毎に品質目標をたてる。品質目標は達成可能であることが重要で、具体的な数値とともにその達成基準が明確でなければならない。具体的には顧客苦情を3ポイント減少させる、逸脱を5ポイント下げる、顧客満足度を10ポイント増加させるなどの目標を設定する。また定期的にマネジメントレビュを実施し、品質改善に関する適切な指示を出す必要がある。マネジメントレビューのレビューという用語は「見直し」を意味しており、経営者による品質システムとリソースの見直しを指す。
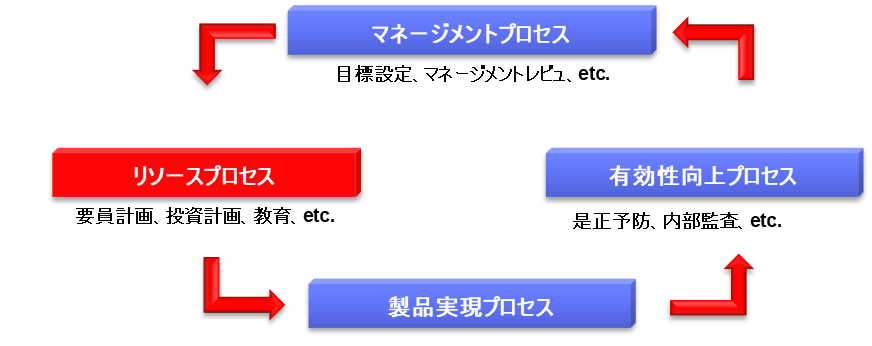
次にリソースプロセスでは、経営者は適切なリソース(人、モノ、金)を配分する。口頭で指示するだけでなく、具体的なリソースの準備が品質改善の実行には不可欠である。例えば要員を雇用する、教育訓練を実施する、コンサルタントを雇うといった施策が含まれる。特に医療機器の場合、クラス2しか設計した経験のない人にクラスⅢを設計させることは不適切であり、適切な能力を持つ要員を雇用することが重要である。
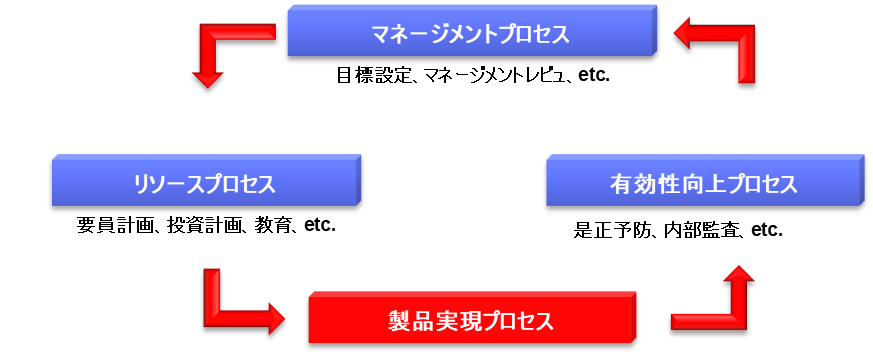
製品実現プロセスでは、QMSに従って、研究・開発・設計・製造・流通・サービス等を実施する。このプロセスの目的は、ユーザニーズ(要求)に合致した製品を市場に出荷し、顧客満足度を得ることにある。
有効性向上プロセスでは、顧客苦情などの収集を行い、再発防止に向けた是正措置・予防措置を講じる。是正措置で重要なことは、問題の根本的原因を調査し、それを解消することによって再発を防止することである。ここで是正と修正は異なることに注意が必要である。
また有効性向上プロセスの重要な要素として内部監査があり、これは「Self Inspection」(自主的な査察)と呼ばれる。Self Inspectionは日本の省令等では「自己点検」と訳されているが、この用語は適切ではない。企業は自らの内部監査等によって日々リスクを発見し、是正・予防を行うことが重要であり、当局査察で指摘されるのを待って改善するのではなく、積極的に改善活動を実施することが求められる。
10.3 品質管理の階層構造
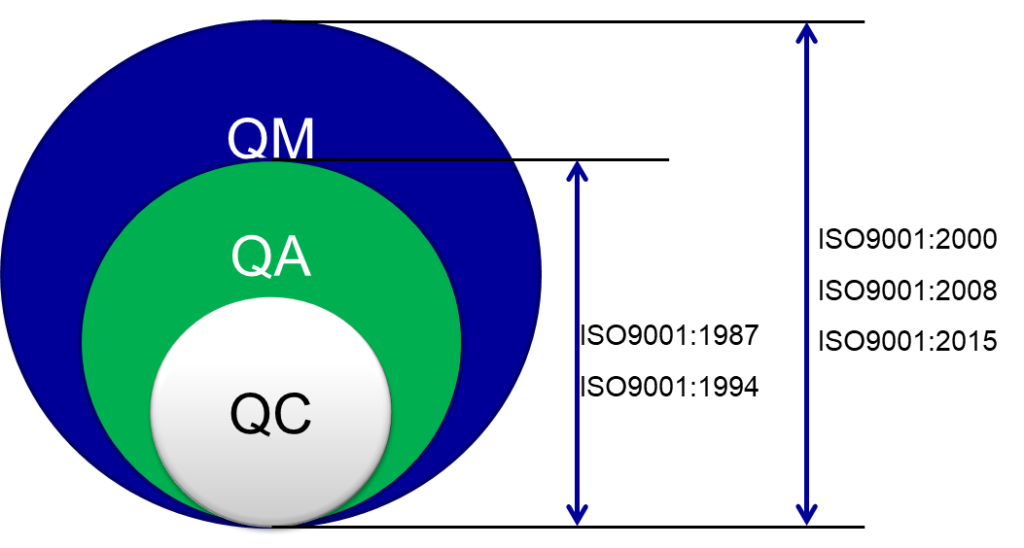
最上位にQM(Quality Management:経営者による品質管理)があり、その下にQA(Quality Assurance:品質保証)、さらにその下にQC(Quality Control:品質管理)が位置する。これらの演説は歴史的な発展の過程を示している。
当初はQCのみが存在し、その後QAが去り、最終的にQMがかかることで最新の力構造が完了した。が、2000年版以降はQMの概念が強化され、経営者による品質管理責任が重視されるようになった。
経営者は経済的な理由のみで経営判断を行うべきではないということが強調されており、品質システムの確立と維持に対する経営者の積極的な関与が求められている。発展は、品質管理が製品個々の管理(QC)から、システムとしての保証(QA)へ、さらには経営者主導の品質管理(QM)まで進化してきた過程を表している。
10.4 品質システムの意義
品質システム(QS)の基本はPDCAサイクルにある。品質システム(QS)が存在するということは、今日よりも明日、明日よりも明後日は品質が向上するといった保証が存在することを意味する。このような品質システムの仕組みはQuality Management System(QMS)と呼ばれる。
FDA等の査察では、企業自らが品質システム(QS)を確立し、査察が実施されていなくとも査察官と同様の目線(レベル)で指摘・改善活動が実施されていることを確認する。そのためには優秀な監査要員の確保が最重要となる。生え抜きの社員だけでは、特に予防処置(リスク管理)は難しい。これは他社での経験がないため、潜在的なリスクに気付きにくいためである。したがって、コンサルタントを雇うなど、外部の知見を取り入れることも重要である。品質システム(QS)が確立されている企業は、査察官にとって「安心」できる企業として評価される。
10.5 ICH Q10における医薬品品質システム
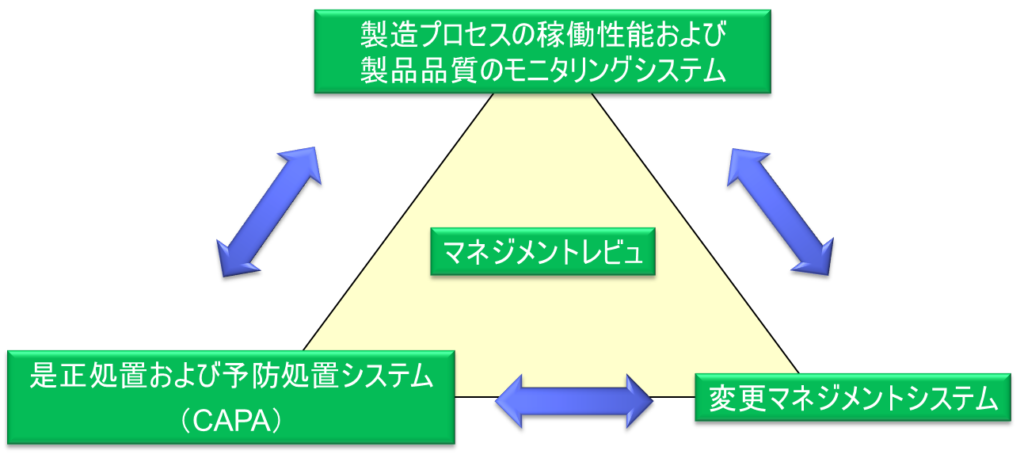
ICH Q10は、国際標準化機構(ISO)の品質概念に基づき、製造管理及び品質管理に関する基準(GMP)を包含し、ICH Q8「製剤開発」及びICH Q9「品質リスクマネジメント」を補完する、実効的な医薬品品質システムのモデルを提供する。このモデルは製品ライフサイクルの異なる段階にわたり実施することができる。
ICH Q10では、経営層による四つの要素の統括管理を要求している。すなわち、製造プロセスの稼働性能および製品品質のモニタリングシステム、是正処置および予防処置(CAPA)システム、変更マネジメントシステム、そしてマネジメントレビュである。これらの要素は相互に関連しており、例えば製造プロセスの稼働性能や製品質のモニタリングシステムで問題が発見された場合は、CAPAシステムを通じて問題の再発防止を図り、必要に応じて変更マネジメントシステムを通じてQMSの変更を行う。このような活動の結果はマネジメントレビューを通じて経営層に報告され、必要な改善指示が出されることになる。
10.6 ISO-9001:2015におけるPDCAサイクル
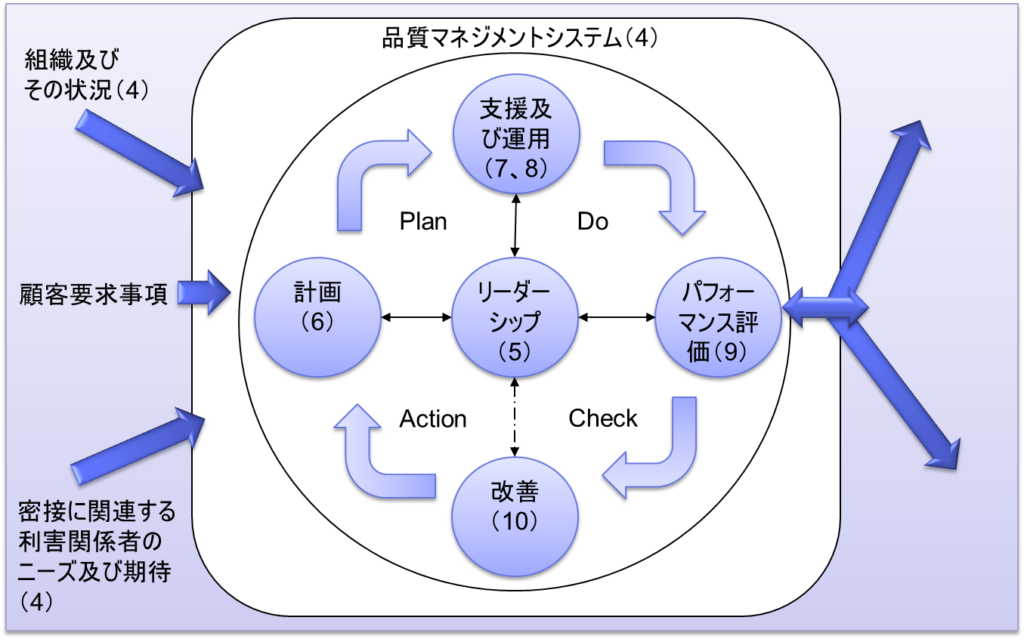
ISO-9001:2015では、品質マネジメントシステムの中心にリーダーシップを置き、その周辺をPDCAサイクルが簡潔な構造となっている。
まず計画(Plan)として、「6. 次に実行(Do)として「7.計画」のプロセスがある。 「支援及び運用」と「8. 「運用」のプロセスがあり、ここで実際の業務が展開される。 パフォーマンス評価」があり、改善(Action)として「10. 「改善」のプロセスが構成されている。
このPDCAサイクル全体を「4. さらに、「組織及びその状況」や「顧客要求事項」、「密接に関連する利害関係者のニーズ及び期待」といった外部配慮も考慮して、品質管理システムを運用することが求められている。
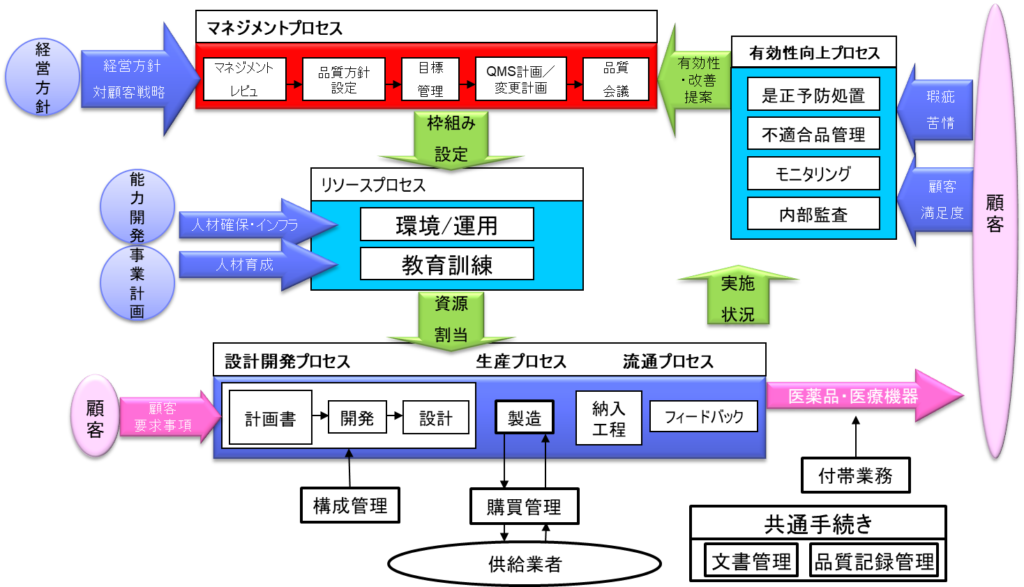
10.7 品質管理システム(QMS)とは
品質管理システム(QMS)は、複数のプロセスが相互に関連し合い、インプットからアウトプットを発生させる構造としてできる。具体的には、経営方針から始まり、対顧客戦略、事業計画、能力開発などの長時間が設定され、それに基づいて各種プロセスが展開される。
主要なプロセスとして、設計開発プロセス、生産プロセス、流通プロセスがあり、これらは顧客要求事項を満たすために構築される。また、これらのプロセスを待機共通手続きとして、文書管理、品質記録管理、付帯業務などが存在する。
さらに、品質システムの有効性を確保するために、不適合品管理、モニタリング、内部監査、是正予防措置といった有効性向上プロセスが順調に進んでいます。品質目標の見直しに活用される。
また、リソースプロセスとして、人材確保・インフラ、人材育成、資源割当などが実施され、これらは供給業者の購買管理や構成管理とも連携している。されることが求められている。
10.8 品質システムの継続的改善
品質システムの継続的な改善には、まず経営者の強いコミットメントが不可欠である。そして人材、設備、資金などのリソースを適切に配分し、品質システムを効果的に運用する必要がある。定期的な内部監査を通じて品質システムの有効性を評価し、必要な改善を行うことも重要である。また品質データを適切に収集・分析し、それに基づいて改善活動を行うことで、より効果的な改善が可能となる。さらに従業員の能力向上のため、継続的な教育訓練を実施することも欠かせない。これらの要素を適切に組み合わせ、PDCAサイクルを回すことで、品質システムの継続的な改善が実現できる。