
FDA Design Control Guideとは
はじめに
医療機器の開発において、安全性と有効性は最も重要な要素である。患者の命を預かる製品である以上、その設計プロセスには厳格な管理が求められる。1997年3月11日に米国食品医薬品局(FDA)が発行した「Design Control Guidance for Medical Device Manufacturers」(医療機器メーカーのための設計管理ガイダンス)は、こうした背景から生まれた画期的な指針であり、今日まで医療機器開発の基盤となっている。今回は、このガイダンスの概要と意義について解説する。
FDA Design Control Guideとは何か
FDA Design Control Guideは、医療機器の設計開発プロセスを体系的に管理するための指針である。正式名称は「Design Control Guidance for Medical Device Manufacturers」であり、1997年3月11日に発行された。このガイダンスは、FDAの品質システム規則(Quality System Regulation、21 CFR Part 820)の設計管理要件を満たすための詳細な解説と実践方法を提供している。
特筆すべきは、このガイダンスが単なる規制文書ではなく、医療機器産業における設計管理のベストプラクティスを集約した実用的な手引書となっている点である。
歴史的背景
1990年代初頭、医療機器の設計欠陥に起因する重大な事故や製品回収が相次ぎ、FDAは医療機器の設計プロセスに対する規制強化の必要性を認識した。1996年に改訂された品質システム規則(QSR)に設計管理の要件が追加され、翌1997年にこのガイダンスが発行された。
それまでの医療機器規制が主に製造プロセスに焦点を当てていたのに対し、このガイダンスは「設計こそが品質の源泉である」という考え方を明確に打ち出した点で革新的であった。
ガイダンスの主要構成要素
FDA Design Control Guideは、医療機器の設計開発プロセスを次の主要な要素に分けて説明している。
1. 設計計画(Design Planning)
設計活動の計画立案と文書化に関する指針。責任者の割り当て、必要なリソースの確保、スケジュール管理などが含まれる。
2. 設計インプット(Design Input)
製品の要求事項を特定し、文書化するプロセス。ユーザーニーズ、意図する用途、規制要件、安全性要件などが含まれる。
3. 設計アウトプット(Design Output)
設計インプットに基づいて作成される成果物。図面、仕様書、製造指示書、ソフトウェアコードなどが含まれる。
4. 設計レビュー(Design Review)
設計の各段階で実施される体系的かつ文書化されたレビュー。設計の妥当性を評価し、問題点を特定する。
5. 設計検証(Design Verification)
設計アウトプットが設計インプットの要求事項を満たしていることを確認するプロセス。テスト、分析、検査などが含まれる。
6. 設計バリデーション(Design Validation)
最終製品が意図された用途や用途に関連するユーザーニーズを満たしていることを確認するプロセス。実際の使用環境を模擬した条件下での評価が含まれる。
7. 設計移管(Design Transfer)
設計を製造へ移管するプロセス。設計仕様が製造仕様に正確に変換されることを確保する。
8. 設計変更(Design Changes)
設計変更の管理方法に関する指針。変更の識別、文書化、評価、承認のプロセスが含まれる。
9. 設計履歴ファイル(Design History File)
設計開発の記録を含むファイル。設計の全履歴を追跡可能にする。
ウォーターフォールモデルと実際の開発プロセス
ガイダンスは、設計プロセスを説明するためにウォーターフォールモデルを採用している。しかし、実際の医療機器開発は直線的ではなく反復的であることを認識し、以下の図(ガイダンス内のFigure 5)を用いて、各要素間の相互作用と反復的な性質を示している。
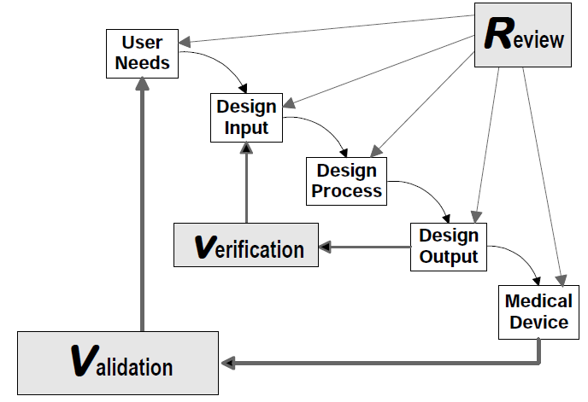
この図は、医療機器開発における「総合的な設計管理」の概念を表しており、設計の各段階が相互に影響し合う動的なプロセスであることを強調している。
ガイダンスの革新性と影響
このガイダンスが医療機器産業にもたらした革新性と影響は、以下の点に集約される。
1. リスクベースアプローチの導入
設計の各段階でリスク管理を統合する必要性を強調した。これにより、潜在的な危険性を早期に特定し、対策を講じることが可能になった。
2. ユーザー視点の重視
「意図された用途」や「ユーザーニーズ」に基づく設計の重要性を強調した。これは後のヒューマンファクターエンジニアリングの発展に大きく貢献した。
3. トレーサビリティの確立
設計インプットから最終製品まで、すべての決定と変更を追跡可能にする枠組みを提供した。これにより、問題発生時の原因特定が容易になった。
4. グローバルハーモナイゼーションへの貢献
このガイダンスの考え方は、後のISO 13485(医療機器の品質マネジメントシステム規格)や他国の規制にも大きな影響を与え、国際的な規制調和の基盤となった。
日本における影響と適用
日本においても、医薬品医療機器等法(旧薬事法)の改正や、QMS省令(医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令)の制定に、このFDAガイダンスの考え方が大きく反映されている。
特に、2005年の薬事法改正で導入された設計管理の要件は、FDA Design Control Guideの影響を強く受けており、日本の医療機器メーカーもこの枠組みに基づいた品質システムの構築が求められている。
結論
FDA Design Control Guide(1997年3月11日)は、単なる規制文書を超え、医療機器の品質と安全性を確保するための思想的基盤を提供した。「設計段階から品質を作り込む」という考え方は、今日の医療機器産業の礎となっている。
技術の進化や規制環境の変化にかかわらず、患者の安全を最優先に考え、体系的かつ厳格な設計プロセスを実践するという基本理念は、これからも医療機器開発の中核を成すものである。医療機器に関わるすべての専門家にとって、このガイダンスの本質を理解することは、今なお必須の知識であり続けている。
関連商品







