
記述統計と推測統計
FDA QSR (Quality System Regulation)の§820.250は、医療機器の品質保証におけるデータ分析の重要性を明確に規定している。
この規制要件は、製造業者に対して、品質データを体系的に収集し、分析し、その結果を品質システムの改善に活用することを求めている。このデータ分析アプローチは、主に記述統計と推測統計(サンプリング統計)の二つの方法論に基づいている。
§820.250 統計的手法
(a) 適切な場合、各製造者は、工程能力及び製品特性の許容可能性を確立し、管理し、検証するために必要な有効な統計的技法を特定するための手順を確立し、維持すること。
(b) サンプリング計画を使用する場合は、有効な統計的根拠に基づいて作成すること。 各製造者は、サンプリング方法が意図された用途に対して適切であることを確認し、変更が生じた場合にはサンプリング計画を見直すことを確実にするための手順を確立し、維持するものとする。 これらの活動は文書化されなければならない。
§820.250(a)が記述統計であり(b)が推測統計(サンプリング統計)である。
記述統計は、収集したデータの特性を客観的に把握し、その特徴を明確化するための基本的な手法である。
例えば、製造工程で得られた測定値や検査結果について、平均値、中央値、標準偏差などの統計量を算出することで、プロセスの安定性や変動の程度を定量的に評価することができる。
また、ヒストグラムや管理図などの統計的グラフを用いることで、データの分布や経時的な変化を視覚的に理解することが可能となる。
これらの分析結果は、製造プロセスの現状を正確に把握し、改善の必要性を判断するための客観的な根拠となる。
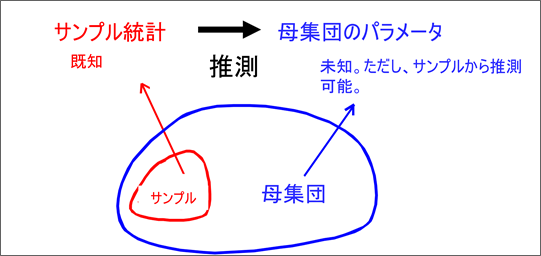
推測統計(サンプリング統計)
一方、推測統計は、限られたサンプルデータから母集団全体の特性を推定する手法である。
全数検査が現実的でない場合や、破壊検査が必要な場合など、全ての製品を検査することが困難な状況で特に重要となる。
例えば、製造ロットから統計的に適切なサンプルサイズを決定し、そのサンプル検査結果から全体の品質水準を推定することが可能となる。
この際、統計的な信頼性を確保するため、適切なサンプリング計画の策定と、統計的な有意性の評価が不可欠となる。
FDA QSR 820.250は、これらのデータ分析手法を品質システムの中で効果的に活用することを求めている。具体的には、以下のような活用が想定される。
製造プロセスの管理では、工程内検査データを統計的に分析し、プロセスの安定性や能力を継続的にモニタリングする。異常値や傾向の早期発見により、品質問題の予防的対応が可能となる。
製品の設計検証では、試作品の性能データを統計的に分析し、設計仕様への適合性を客観的に評価する。この分析結果は、設計の妥当性確認や改善の判断材料となる。
さらに、苦情データや市場からのフィードバックについても、統計的な分析を行うことで、潜在的な品質問題や改善機会を特定することができる。これらの分析結果は、是正・予防処置(CAPA)システムへのインプットとして活用される。
このようなデータ分析アプローチは、単なる規制要件への対応ではなく、医療機器の品質保証における本質的な活動として位置づけられる。
適切なデータ分析により、品質リスクの低減、製品品質の向上、そして最終的には患者安全の確保につながるのである。
製造業者は、これらの統計的手法の基本を理解し、自社の品質システムの中で効果的に活用することが求められる。







