
なぜ継続的な臨床評価が必要か
なぜ継続的な臨床評価が必要か
医療機器はヒトに対して使用するものであるため、臨床評価は必須である。
認証/承認申請時には、臨床評価の結果を提出しなければならない。
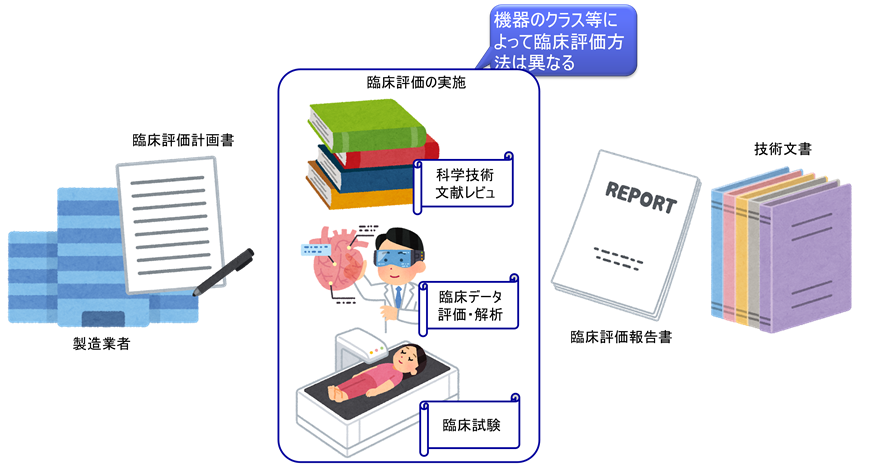
設計開発時の臨床評価(設計バリデーションの一環)
欧州の医療機器規則(MDR)における市販後臨床フォローアップ(PMCF)は、医療機器が市場に出た後も安全性と有効性を確実に確認するために必要である。これは、臨床データを継続的に収集し、製品が実際の使用環境でどのように機能しているかを監視するための重要な活動である。
継続的な臨床評価が必要な最も重要な理由は、設計開発段階でリスクマネジメントプロセスにおいて特定したベネフィット/リスク比が、実際の使用環境において継続的に有効であるか否かを確認する必要があるからである。開発時に想定したベネフィットとリスクのバランスは、実臨床での使用実態や新たな知見により変化する可能性がある。そのため、継続的なモニタリングが不可欠である。
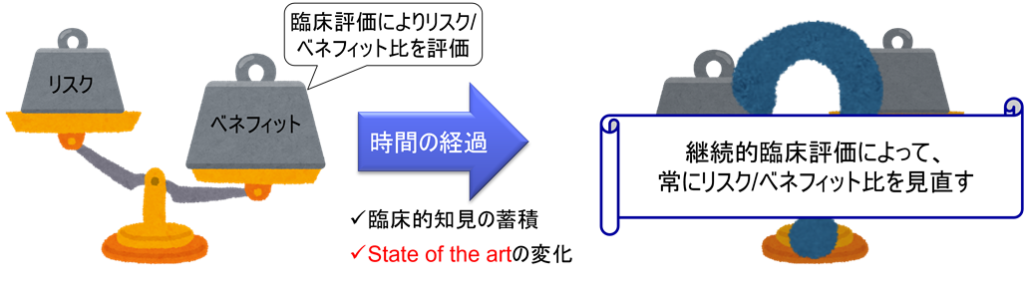
問題は、上市後には、ハザードは増加する一方であり、ベネフィットは下がる一方なのである。
例えば、米国で猫を洗った後に電子レンジに入れたという事故があった。製造業者はまさか生き物を電子レンジに入れるとは想像していなかった。このようにユーザの属性や製品の歴史によっては、上市後に新たなハザードが発見されるのである。
一方で、上市時点では他に同様の医療機器がなかったり、他の治療方法がなく、ベネフィットがあったが、上市後数年経った後に類似品が多く発売されたり、医薬品によって治療が可能になるなど、ベネフィットは下がる一歩である。例えば、ガスターと呼ばれる医薬品で胃潰瘍の治療が出来るようになった事例などがある。
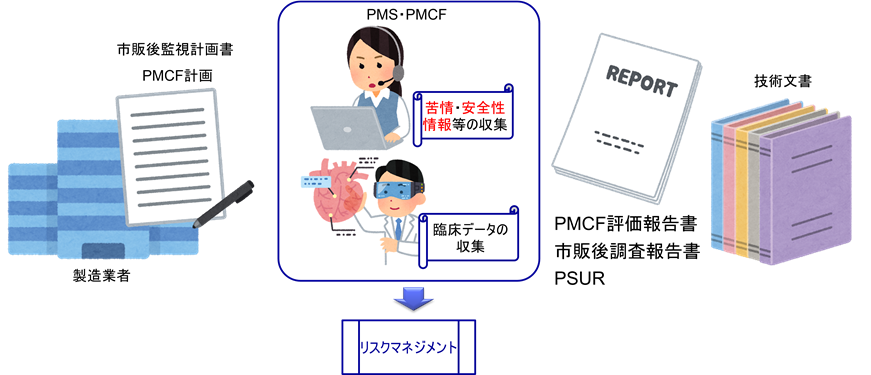
上市後の臨床評価(OMCF)
PMCFの実施は、ほとんどの医療機器において必須である。なぜならば、設計開発時におけるリスクマネジメントが不完全である可能性があるためだ。
PMCFが不要な医療機器は、歯列矯正器具など製品の歴史が古く、安全性が確立されている場合のみである。
医療機器は、実験室のテストや臨床試験だけではわからない「実際の使用条件」による影響を受ける可能性がある。新しい患者グループでの使用や医療現場での使用経験が増えることで、新たなリスクや改良すべき点が見えてくることがある。臨床試験は限られた環境で行われるため、実際の使用場面で起こりうるすべての状況を想定することは難しい。これらを見逃さないために、PMCFによって情報を収集し、製品の安全性と効果を確認し続けることが重要である。
また、医療機器は長期間使用されることで、性能が変化したり、予期せぬ影響が出たりする可能性がある。継続的な評価によって、製品の耐久性や信頼性を確認し、長期使用による影響を把握することができる。これらの情報は、想定したベネフィット/リスク比の妥当性を検証する上で重要なデータとなる。
MDRにおいては、メーカーが市場投入後も機器の性能を保証し、問題があれば早期に対処する責任がある。医療技術は日々進歩しており、新しい使用方法や、それに伴う新たなリスクが発見されることもある。PMCFを通じて、そうした新しいリスクを早期に発見し、ベネフィット/リスク比の再評価を行い、必要に応じて適切な対策を講じることが可能である。
実際の臨床環境で医療機器が使用されることで、新しいリスクが発見される場合や、逆に今までわからなかった利点が明らかになることがある。実際に使用している医療従事者からのフィードバックは、製品改善のための貴重な情報源となる。PMCFを通じて収集したデータを基に、これらの新たな情報をリスクマネジメントプロセスに反映させることで、当初のベネフィット/リスク比が依然として妥当であるか、あるいは変更が必要かを判断する。
このような継続的な臨床評価は、単に規則で決められているから行うというものではない。医療機器の開発時に想定したベネフィット/リスク比が実臨床においても維持されているかを確認し、必要に応じて適切な措置を講じることで、医療機器の安全性と有効性を確保するための重要な活動である。この継続的なモニタリングにより、医療機器がユーザーや患者にとって安全であり続け、予想されたベネフィットを最大限に提供することを保証する。
このように、継続的な臨床評価は、開発時に特定したベネフィット/リスク比の妥当性を継続的に検証し、医療機器の安全性と有効性を確保するための重要な取り組みである。実際の使用環境での長期的な観察を通じて、患者の安全を守り、よりよい医療の実現に貢献しているのである。






