
IOQの実施について
IOQの実施について
最近ではIQとOQを同時に実施するケースが増えている。
これは、2015年にPIC/S GMP Annex 15 「適格性評価とバリデーション」が改定されてから、IQとOQは同時に実施することが可能となったためである。
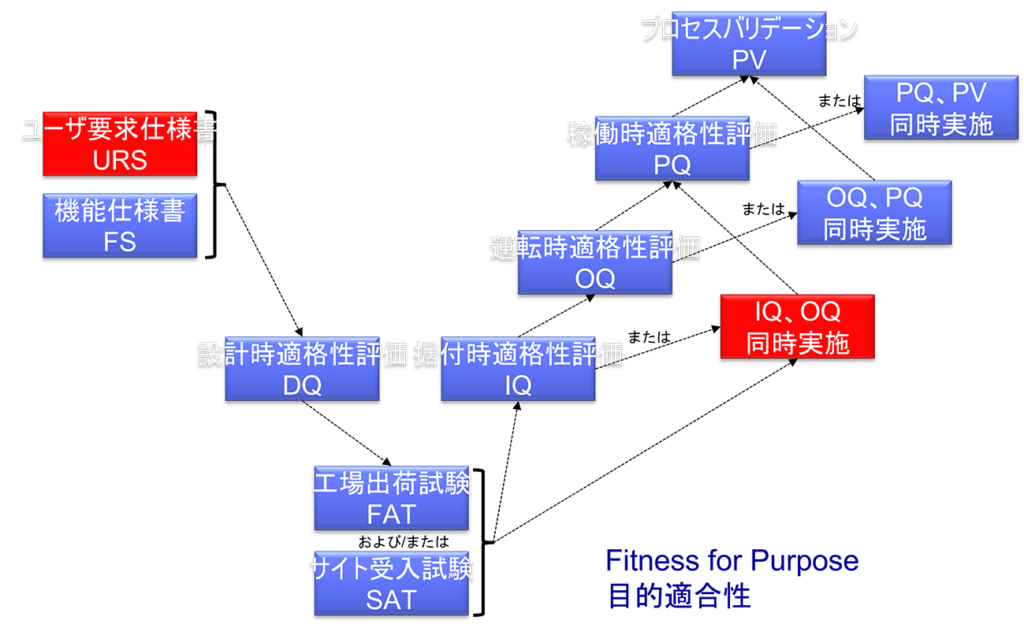
OQは、通常IQの後に実施されるが、装置の複雑さによっては、同時にIOQとして実施しても構わない。
またIQとOQの文書を一つにまとめても構わない。
IQは、装置、施設、ユーティリティもしくはシステムについて実施すること。
IQでは下記の項目などを実施する。
1. エンジニアの図や詳述に対して、構成要素、機器類、装置、配管工事やサービスの正しい設置の相互確認
2. あらかじめ定めた条件に対して正しく据付けられたことの検証
3. サプライヤからのオペレーション・作業要領、メンテナンス要件の収集と照合
4. 計測器の校正
5. 建設材料の検証
OQは、通常IQの後に実施されるが、装置の複雑さによっては、同時にIOQとして実施しても構わない。
OQでは下記の項目などを実施する。
1. システムが設計どおり操作しているかを確かめるためのプロセス、システム、設備に関する知識を基に開発したテスト
2. 運転の上限及び下限/「ワーストケース」を確認するためのテスト
成功裏にOQが終了すれば、標準作業手順および洗浄手順、作業者訓練や予防的メンテナンスの要件等を最終化できる。
DQ、PQの省略について
最近では構造設備とはカタログ品(既製品)を購入することが多く DQはほぼ実施されなくなった。
またPIC/S GMP Annex 15によると、PQはOQもしくはプロセスバリデーションと合せて実行してもよい。
従って構造設備のバリデーションにおいてDQやPQはほぼ実施されない。
IQとOQが完了してから、PQを実施すること。
しかし、場合によっては、PQはOQまたはプロセスバリデーションと合せて実行してもよい。
PQでは下記の項目などを実施する。
1. ワーストケースのバッチサイズで、製造用原料、適格性評価された代用品、または通常の運転条件で同じ挙動をとることが証明された模擬製品を用いたテスト。
プロセスの管理状態を確認するために用いるサンプリングの頻度が適切であるという根拠を示すこと。
2. 開発段階からの運転範囲を裏付ける文書化された証拠がない限り、テストは意図したプロセスの運転範囲をカバーすること。
FAT/SAT
特に新規であったり複雑な技術が組み込まれた装置は、製薬企業への移送前(IOQ実施前)にベンダー側で評価してもよい。
また装置を設置する前に、ベンダー側でURS/機能仕様書への適合性を確認すること。
適切な理由がある場合、移送や据付作業によって機能に影響がないことが示されれば、文書類のレビュやテストの一部をFATもしくは他の段階で実施することもでき、IQ/OQをオンサイト(製薬企業)で繰り返す必要はない。
つまりベンダーがFATを適切に実施していれば、IOQの実施は(かなり)省略できることになるのである。
なお、FATは製造現場(製薬企業)での装置受入後にSATを実施することによって補完することもできる。
筆者はしばしば製薬企業やベンチャー企業のIOQの実施を支援する。
質問の多くはFAT/SATとIOQとの違いや、PQとプロセスバリデーションの違いである。
かつては適格性評価は製薬企業側において実施しなければならないとされてきた。
多くの場合、製薬企業はベンダーに依頼しそれら文書の作成を実施してきたが、あたかも製薬企業が実施したかのような文書としていた。
しかしながらIOQといった適格性評価を誰が実施するかが重要ではなく、最終的に当該構造設備を使用して製造する製品の品質が保証されることが重要なのである。
多くの場合、IOQの実施はベンダーに依頼することになる。







