
ISO-9001の認証を受けていても品質が向上しない訳とは
ISO-9001やISO-13485(医療機器メーカの場合)を取得しているにもかかわらず、品質(歩留まり等)が一向に向上せず、顧客苦情が減少しなかったり、回収が頻繁に起きたりといったケースが多い。
その最大の理由は、これまでのISO-9001などの国際規格はその記述があいまいであり、企業側にとって解釈の余地(幅)が広いことがあげられる。
そこでISO-9001:2015やISO-13485:2016などでは、解釈がバラバラにならないように、平易かつ分かりやすい箇条となっている。
しかしながら、最も大切なことは、企業が国際規格の趣旨や精神をよく理解して、自社のQMSを構築することである。
ISOやIECなどの国際規格は、過去の失敗や経験に基づいて作成された、いわば人類の知恵である。
それら知恵を借りず、適切に理解しなければ、先人の轍を踏み、問題が解決せず、品質の向上も望めない。
ISO-9001などの品質規格に従ってQMSを構築するということは、品質保証の仕組みがあるということであり、PDCAサイクルがあり、「今日よりも明日、明日よりも明後日は品質が向上していく」という保証があるということである。
そこで最も大事なのは、CAPAや内部監査などの改善プロセスである。
改善プロセスが正しく運用されなければ、経営者は自社の品質問題に気付くことがなく、必然的にリソースを適切に割り当てることができず、品質が向上しない(歩留まりが下がらない、苦情が減少しない)といった負のスパイラルに落ちるのである 。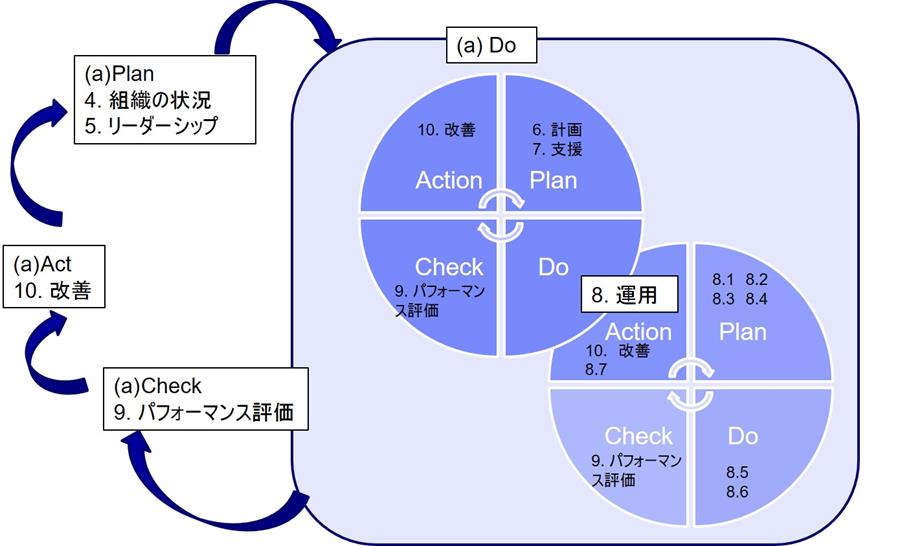
図.ISO-9001:2015におけるPDCAサイクル
またよく問題になるのは、ISO-9001やISO-13485(医療機器メーカの場合)を取得しているにもかかわらず、FDAなどの査察において指摘を受けるケースが多い。
その訳とは何であろうか。
まず第一に筆者が考えることは、ISOの認証機関は商売である。
したがって、あまり厳しく多くの指摘を出し、認証を渋った場合、顧客が他社に流れてしまうことがある。
したがって、必然的に当たり障りのない指摘を出しがちである。
しかしながら、FDA等の査察においては、自国民の安全性を担保するために実施するわけであるため、必然的に厳しい指摘を十分な数だけ出すこととなる。
第二に、ISO認証などの第三者監査は、ISO-17011においてコンサルテーションが禁じられている。
その理由は何個か挙げられるが、認証官の能力(そもそもコンサルタントではない)によって内容が異なること、企業毎に不公平にならないことなどが考えられる。
したがってQMSや記録の品質をどうやって向上させるかといった指導は全くないのである。
第三に、これが本質的であるが、日本の規制当局(PMDA、都道府県等)や認証機関の監査は、要素監査である。
規制要件に対して、要件1つ1つに対して適合しているかどうかを監査することとなる。
それに対して、FDA等の査察は、追跡調査である。
たとえば、
- 苦情一覧表をチェック
- ある顧客苦情に関して、
- いつ、苦情を受け取ったか
- 原因調査を行ったか
- 有害事象報告の要否を判断したか
- 顧客へどのように回答したか
- CAPAを実施したか
- 根本的な原因は何であったか
- 手順書(またはその他関連資料)の何を変更したか
- 変更後の手順書に関して、教育訓練をいつ、誰に実施したか
といった具合である。これらの質問に的確に速やかに回答するためには情報の整理と連携は必要不可欠である。
読者諸氏も国際規格の真の意図をよく理解し、顧客(患者、医療従事者等)のために品質を向上させ、品質保証を十分に行われることを期待したい。








