第8章 FDA査察対応の考え方と準備
8.1 FDA査察への準備の基本姿勢
FDA査察の準備では、まず査察の種別に応じた適切な理解が必要である。医薬品の場合はコンプライアンスプログラム(CP)を、医療機器企業の場合はクオリティシステムインスペクションテクニック(QSIT)を十分に理解することが重要である。申請を伴う査察の場合は申請資料の中身をよく理解しておかなければならない。また、内部監査を実施し、指摘事項に対する是正計画を作成しておく必要がある。これは、査察での指摘を未然に防ぎ、適切な対応を準備するための重要なステップとなる。
実地訓練として、特に模擬査察(モック査察)の実施が極めて重要である。緊張状態で、かつ英語と日本語の通訳が入る状況下では、日常的な実力を発揮することが難しい。そのため、受け答えを含めた訓練を入念に実施し、本番と同様の環境下での対応に慣れておく必要がある。
査察計画書の作成も重要な準備事項である。現場の従業員一人一人がすべきことを明確にし、職場を整理整頓し、全ての機器が正常で校正されていることを保証しなければならない。
査察官の質問に対しては、正直かつダイレクトに回答することが求められる。「私にはわかりません」という回答は可能であるが、その場合は必ず知識があり責任を持っている人を呼ぶ必要がある。決して想像で答えてはならない。プロ意識を持ち、礼儀正しく協力的な態度で臨むことが重要である。査察官はVIPゲストであり、人間の性質として怒らせるとアグレッシブになってしまう可能性があることを認識しておかなければならない。
8.2 査察対応計画書の作成と活用
査察対応計画書は、期待を知り、権利を理解し、混乱を避け、FDA査察官の発見事項に対して的確に回答するために必要不可欠なものである。計画書には以下のような詳細な内容を含める必要がある。
まず、査察官の出迎えと挨拶に関する詳細な手順を記載する。これには空港やホテルからの送迎なども含まれる。査察会場の設定については、プレゼンテーションルームやDocument reviewを行う部屋の配置、温度管理、照明の調整など、細かな環境設定まで記載する。
査察の取り仕切り担当者の指定においては、その役割と責任を明確に定義する。記録係の指定と役割、査察官への同行者の指定なども具体的に記載する。回答者の選定では、主回答者と詳細説明者の役割分担を明確にする。
バックヤードの取り仕切り担当者と配置についても詳細に定める必要がある。リクエストされた文書の提出担当者、Wrap-up meetingおよびClose out meetingの出席者、FDAのObservationへの対応担当者などを明記する。また、査察時の制限事項として、写真撮影の可否や立入制限区域などについても明確に記載する。
さらに、コーヒーの運搬係や温度調整担当者など、細かな役割まで定義しておく必要がある。クローズアウトミーティング時の経営者のメモ帳やボールペンの準備など、細部にわたる準備事項も計画書に含める。
8.3 FDA査察の準備における重要事項の詳細
FDA査察の準備において、まずFDAの考え方を理解し、会社としての考えを確立することが重要である。該当するCode of Federal Regulations(CFR)全般および最新のガイダンス等について熟知し、手順書、記録等のCFR上必要な事項を整備しなければならない。
現在改訂中のQMSについては、あくまでも是正措置のために改訂している旨を明確にし、すでに発行され使用されてきたかのような表現は避けるべきである。その理由は、最新のSOPと記録が合わないという矛盾が生じる可能性があるためである。あくまでも旧手順書で説明し、指摘された際に「それはもう我々もわかっています。だから今、手順書を改定しました」と説明することが適切である。
改訂中のQMSがある場合は、英語版を作成しておくことが望ましい。ただし、すべてのSOPを英訳する必要はなく、必要に応じて通訳が読み上げたり、最近ではGoogleレンズで翻訳を確認したりすることも可能である。説明能力はCFR(GMP、QSR)の理解度に比例するため、一夜漬けでの対応は不可能である。
8.4 情報収集の徹底
査察に向けた情報収集において、まず査察の目的、対象品目、日程、レビュー予定のリストを入手する必要がある。査察官の名前、性別、専門分野はFDAからの第一報に記載されているが、それ以外にも体格、食事上の制限(菜食主義者等)などの情報も確認しておく必要がある。特に体格情報は、作業用の履物を準備するために必須である。
査察官に関する情報として、過去に書いたEstablishment Inspection Report(EIR)が入手可能であれば、それを入手して研究しておくことが望ましい。また、査察官の到着時間を把握し、開始時のミーティング時間を設定する。通常、査察は午前9時に開始されることが多い。あまり早くホテルへ迎えに行くと、査察官が最終チェックやミーティングを行う時間が確保できなくなってしまう。迎えに行く時間を適切にコントロールすることで、査察官の準備時間を確保することができる。
8.5 査察会場の準備と設営
査察のためのDocument review(書類審査)を行う部屋は、騒がしくない場所、せわしくない場所、居心地の良い場所を選定する必要がある。日本特有のチャイム音は、アメリカの文化にはないため、可能であれば部屋のチャイムやスピーカーは切っておくことが望ましい。
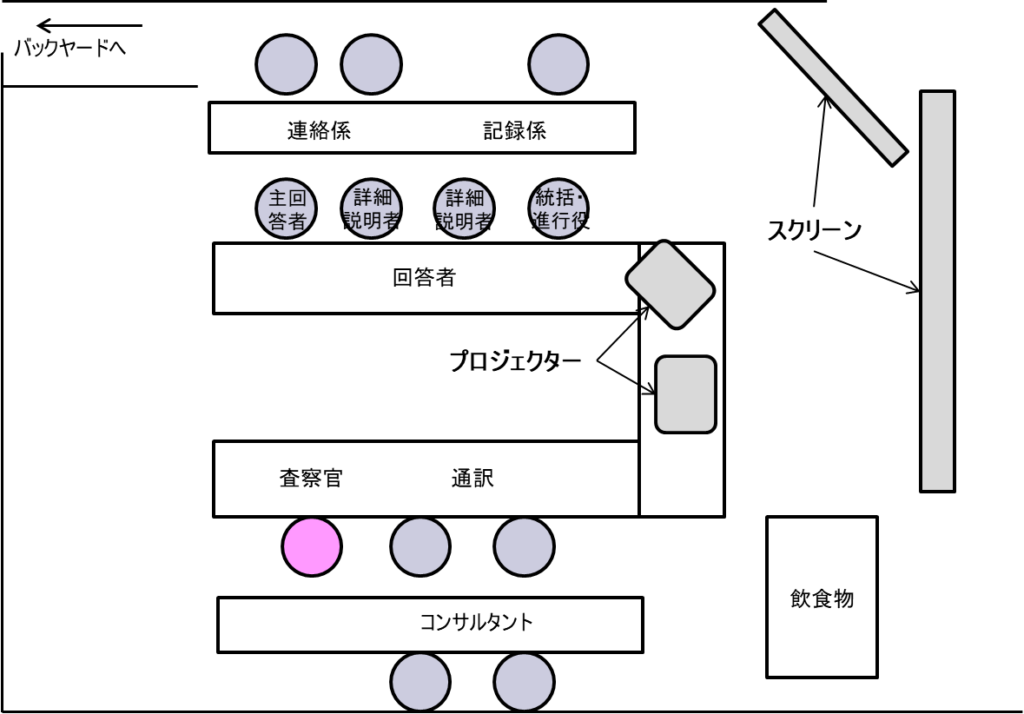
部屋のレイアウトについては、特に慎重な検討が必要である。理想的なレイアウトとして、スクリーンを2台設置することが推奨される。この配置の利点は、査察官から要望された資料をメインスクリーンに映しながら、もう一方のスクリーンでは当該領域に関する補足資料(製造、試験検査、文書管理、記録管理、CAPA、苦情など)をパワーポイントで表示できることにある。
通訳は必ず前方に配置する。査察官は日本語を読めないため後方でも問題ないが、通訳は資料を正確に読み取れる位置にいる必要がある。対面には主回答者を配置し、全体の70~80%の質問に対応できるようにする。詳細な説明が必要な場合は、主回答者が詳細説明者を指名して回答させる体制をとる。
また、統括進行役(通常は品質保証部門の責任者)を適切な位置に配置する。この役割は査察官のカウンターパートとして極めて重要である。資料の要求や質問に対して関係者が協議している間、査察官を置き去りにしないよう、常に状況を説明し、コミュニケーションを維持する必要がある。
8.6 バックヤードの運営と連携
バックヤードは資料の準備と管理の中心となる重要な機能を果たす。FDAの要求に応じて必要な文書を入手・レビューし、付箋が貼られていないか、欄外記載がないか、鉛筆書きがないかなど、細かなチェックを行う。バックヤードの人員配置について、多くの企業がフロントヤードに優秀な人材を集中させる傾向があるが、これは避けるべきである。バックヤードにも必ず優秀な人材を配置し、資料の迅速な検索と適切な判断ができる体制を整える必要がある。
資料の提出プロセスも明確に定める必要がある。連絡票を使用して要求内容を正確に伝え、資料はクリアファイルに入れてトレイで受け渡す。直接手渡しは避け、会話の流れを中断させないようにする。統括進行役は、提出された資料を確認し、適切なタイミングで査察官に説明を再開する判断を行う。
8.7 査察対応における役割と責任の体系
8.7.1 対応責任者の要件と職務
対応責任者は、21 CFR(GMP、QSRなど)を完全に理解し、FDA査察の実施方法を熟知していることが求められる。会社の方針やり方、業務内容の詳細を把握しているだけでなく、主要な人材についても熟知していなければならない。過去2年間の品質上の懸案事項を理解し、現在行われている更新、拡張、内装、新設備などの状況も正確に把握していることが必要である。
8.7.2 統括・進行係の重要性
統括・進行係は、通常品質部門長が担当し、査察が始まってからの全体の統括・調整を行う。予め回答者を決めていない予期せぬ質問が来た場合には、適切な回答者を指名する役割も担う。統括・進行係は、査察の円滑な進行を確保する上で極めて重要な存在である。また、質問に対して回答者がいないという事態が発生しないよう、常に状況を把握し、適切な人材を配置する必要がある。
8.7.3 回答者の体制と役割分担
回答者は主回答者と詳細説明者に分類される。主回答者は通常、各部の部長または各課の課長が担当し、その分野における質問の7~8割程度を回答できる能力が求められる。詳細な説明が必要な場合には、詳細説明者が対応することになるが、これは主回答者の指示の下で行われるべきである。
各エリアごとに誰が回答するかをあらかじめ決めておき、複数名の詳細説明者を準備しておくことが望ましい。これにより、特定の質問に対して最も適切な人材が回答できる体制を確保することができる。
査察官とのコミュニケーションにおいては、質問に対して正直かつ直接的に回答することが基本である。「私にはわかりません」という回答は可能であるが、その場合は必ず知識と責任を持つ適切な人材を呼び出す必要がある。決して想像や推測で答えてはならない。
特に注意すべき点として、沈黙に対する対応がある。査察官が考えている間の沈黙に耐えられず、余計な情報を提供してしまう傾向が日本人には見られる。例えば、2023年の記録を見せるよう要求されているのに、2022年の資料もあることを自発的に申し出てしまうようなケースである。このような過剰な情報提供は避けるべきである。
また、複数の担当者が異なる回答をすることがないよう、事前にFAQを作成し、回答内容の統一を図っておく必要がある。同じ質問を複数の担当者にされることは珍しくなく、回答の不一致は深刻な問題として捉えられる可能性がある。
8.7.4 資料探索係の職務内容
資料探索係は、バックヤードにおいて要求された資料の探索、コピーの作成、資料の管理を担当する。優秀な人材を少なくとも1名は配置する必要があり、資料が見つからなくなることを防ぐ重要な役割を果たす。提供する資料には必ずコンフィデンシャルの判と日付を押印し、控えを取ってから渡すという厳格な手順を遵守する必要がある。
8.7.5 記録係の役割と運用
記録係は、査察の進行状況を素早く記録し、査察の場所にいない人々に進捗状況を知らせる重要な職務を担う。この作業は極めて集中力を要するため、複数名を配置し、交代で実施することが推奨される。ZoomやTeams、SNSなどを活用して情報を共有することは可能であるが、音声録音やビデオ撮影は絶対に避けなければならない。
査察官の許可なく録音・録画を行うことは、重大な信頼関係の破壊につながる可能性がある。
記録係は、PCやタブルトを使用して進行状況を継続的に入力する。この作業は疲労を伴うため、2~3人で交代して実施することが望ましい。外部コンサルタントが同席する場合は後方に配置し、通訳への指示や回答の修正などをスムーズに行えるようにする。
8.7.6 連絡係(ランナー)の機能
連絡係は、フロントヤードとバックヤードを連結する重要な役割を果たす。情報連絡、詳細説明者の呼び出し、要求資料の提出についての連絡等を行う。口頭での連絡では手違いが発生する可能性があるため、必ず定められたフォーマットの連絡票を使用する。バックヤードとの連携をスムーズに行うため、2~3名の連絡係を配置し、常に1名はフロントヤードに待機させる体制を整えることが望ましい。
8.7.7 アドバイザー(コンサルタント)の役割
アドバイザーは、査察官の質問の意図や、適切な回答方法についてアドバイスを行う重要な役割を担う。コンサルタントが同席する場合は、場数を踏んでいる経験を活かし、冷静な判断で対応をナビゲートすることができる。担当者がテンパって普段の実力を発揮できない場合でも、コンサルタントが適切なアドバイスを提供することで、円滑な対応が可能となる。
8.7.8 通訳者の重要性と責任
通訳者は、査察官と回答者の間のコミュニケーションを補助する極めて重要な役割を担う。専門用語に慣れている通訳者であっても、製品固有の用語については事前に十分な確認が必要である。回答者の意図が明確に把握できない場合は、査察官に一言断ってから内容を確認することが認められる。
8.7.9 送迎担当者の職務
送迎担当者は、査察官のホテルまでの送迎や出迎えを担当する。英語ができる人材が望ましく、できれば査察に直接関係しない人材を配置することが推奨される。査察官との会話を通じて日本の紹介もできるため、幅広い知識を持った人材が適している。ただし、業務に関する事項については一切話してはならない。

これらの役割と責任の明確な定義と適切な人材の配置は、査察の成功にとって極めて重要である。各担当者が自身の役割を十分に理解し、チームとして協力することで、効果的な査察対応が可能となる。
| 役 割 | 責 任 | 氏 名 | 備 考 |
| 統括・進行係 | 査察全体の統括・調整、進行を行う。 | ||
| 回答者 | 査察官からの質問に回答する。 | ||
| 役 割 | 責 任 | 氏 名 | 備 考 |
| 詳細回答者 | 詳細な回答が必要な場合に回答を行う。 | ||
| 資料探索係 | 資料の探索、コピーを行う。 | ||
| 役 割 | 責 任 | 氏 名 | 備 考 |
| 記録係 | すばやく記録を取り、査察の場にいない人に進捗状況を知らせる。 | ||
| 連絡係 | 査察場とその他の場所をつなぐ。情報連絡、詳細回答者呼出等を行う。 | ||
| アドバイザー | 査察官の質問の意味等、アドバイスを行う。 | ||
| 通訳 | 査察官と回答者間の通訳を行う。 | ||
| 送迎 | 査察官をホテルまで迎えに行く、ホテルまで送る。 | 英語ができる人 |
8.8 監査報告書の取り扱い
FDAやPMDAの査察では、通常、監査報告書を調査されることはない。これは、監査の独立性を担保するためである。しかしながら、監査の指摘に対する是正状況については、高い確率で調査される。
監査は報告書を作成して終了するのではなく、是正処置が完了し、再監査(フォローアップ監査)が終了してはじめて完了となる。多くの企業では、指摘事項が枝葉末節であり、本質的でない内容や単なるエラーの指摘にとどまり、リスクを発見・是正する内容となっていないことが多い。
監査報告書と同様に、マネジメントレビューの結果に対する改善状況も調査されることが多い。ここで重要なことは、マネジメントレビューは、経済面ではなく品質面に対して行われなければならないということである。

8.9 輸出品目に関する留意事項
多くの企業は、米国輸出品目に関する文書と記録のみが調査されると考えがちである。しかし、FDA査察では、輸出品目以外も調査されることがある。これは、FDAの査察官が当該企業の「姿勢」に関心を持っているためである。
特に避けるべき事項として、ダブルスタンダードの存在が挙げられる。企業内で輸出用と国内用といったように、SOPを2系統作ってしまうことは適切ではない

8.10 査察における時間管理とその重要性
8.10.1 「10分ルール」の意義と運用
かつては「15分ルール」として知られていた規定であるが、現在は「10分ルール」として運用されている。これは、査察官からの要求に対して10分以内に何らかの対応を示さなければならないという暗黙のルールである。10分以上、査察官を放置してはいけないという原則であり、これを守れない場合は査察妨害とみなされる可能性がある。
このルールは正式に文書化されているわけではないが、長年の実務経験から確立された重要な運用指針である。2014年に査察妨害に関するガイダンスが発行され、査察の遅延、拒否、制限、拒絶に相当する状況について明確に定義されている。
8.10.2 時間管理の実践的対応
10分以上経過しても資料が提出できない、または回答ができない場合の適切な対応方法がある。このような場合、統括進行係が「申し訳ありませんが、その資料はあと20分ほど必要です」「本日午後からご提示できます」などと明確に説明し、次の質問に移るよう提案する必要がある。何の説明もなく査察官を待たせることは絶対に避けなければならない。
8.10.3 実務的な準備と対策
紙ベースで査察に対応する場合、10分以内に適切な記録を探し出すためには、すべての文書・記録を査察が行われている部屋の近くに配置しておく必要がある。その上で、各部署の担当者が即座に適切な文書・記録を探し出し、届けられる体制を整えておかなければならない。
このために、バックヤードの設置場所や人員配置、連絡体制などを事前に十分検討しておく必要がある。資料の保管方法や検索システムも、この時間制限を意識して整備しておくべきである。
8.10.4 遅延防止のための体制作り
査察官からの要求に対して迅速な対応ができない場合、その企業のシステムや管理体制に問題があるとみなされる可能性がある。そのため、以下のような体制作りが重要となる:
まず、統括進行役が時間管理を行い、要求から経過時間を常に意識する必要がある。ストップウォッチを使用するなどして、厳密な時間管理を行うことが推奨される。
次に、バックヤードとの連携を強化し, 資料の検索や準備に関する効率的なプロセスを確立する必要がある。連絡票などを活用し、要求内容を正確に伝達するシステムを整備することが重要である。
さらに、資料提出のプロセスを標準化し、すべての関係者が手順を理解していることが必要である。これには資料の確認手順やコピーの作成方法なども含まれる。
8.10.5 時間管理の重要性
10分ルールの遵守は、単なる時間管理以上の意味を持つ。これは企業の品質システムの効率性や組織としての対応能力を示す重要な指標となる。迅速な対応ができないということは、日常的な品質管理においても同様の問題が存在する可能性を示唆することになる。
そのため、この時間管理は査察対応の成否を左右する重要な要素として認識し、十分な準備と訓練を行っておく必要がある。模擬査察などでも、この時間制限を意識した実践的な訓練を行うことが推奨される。

8.11 査察妨害行為に関するガイダンス
8.11.1 ガイダンスの背景と目的
2014年10月に、FDAは「医薬品査察の遅延、拒否、制限、拒絶に相当する状況についてのガイダンス」を発行した。このガイダンスの発行背景には、連邦食品・医薬品・化粧品法(FD&C法)に重要な追加が行われたことがある。具体的には、「査察の遅延、拒否、または制限あるいは立ち入りや査察を拒絶する工場、倉庫あるいは施設において、またはそのような工場、倉庫あるいは施設の所有者、作業者あるいは代理業者によって製造、加工、梱包または保管された薬」を不良医薬品とみなすという条項が追加された。
8.11.2 FD&C法704項の規定内容
FD&C法704項は、FDAに対して「合理的な時期に、合理的な範囲内で、合理的な方法で査察を実施する権限」を与えている。ここでいう「合理的」の定義は特に行われていないが、704項に基づく査察の権威が拡大適用した「査察の目的を達成するのに合理的に必要なこと」をFDAは長年維持してきている。
8.11.3 查察の遅延に関する規定
査察の遅延は様々な理由で発生する可能性があり、その中には施設では管理不能なものも含まれる。しかし、所有者、作業者、代理人が意図的に査察を遅らせた場合、FD&C法501(j)項のもとで医薬品は不適合とされる。
遅延とみなされる具体的な行為としては、以下のような状況が含まれる:
- 施設が提案した査察開始日に同意せず、かつそれができない合理的な説明をしない場合
- 査察のスケジュールを立てた後で、施設が合理的な説明をせずに開始日を遅らせる要求をした場合
- FDAが施設の指定された窓口担当者にとった連絡に、施設が応えない場合
8.11.4 査察中の遅延行為
査察中の遅延行為として、正当な理由もなく、稼働していてFDAが査察する権限を持っている査察エリアであるにもかかわらず、特定の日にちあるいは時間になるまで施設のエリアへ入ることを許可しない場合が挙げられる。また、必要な文書あるいは正当な人物にアクセスさせないで、査察官が査察を完了させないように妨害するほどの不当な期間、施設が会議室にFDA査察官を置き去りにするような行為も遅延とみなされる。
8.11.5 製造記録の提供遅延
製造記録に関する遅延として、査察中に明確で正当な時間枠内でFDA査察官が記録を要求したにもかかわらず、FDAが査察の権限を持っているのに、正当な理由なしにFDAが要求した時間枠内に施設が要求された記録を作成することに失敗する場合が該当する。また、FDAがFD&C法704(a)(4)に従って記録を要求するが、正当な理由なしに施設が速やかに要求された記録の作成に失敗する場合も含まれる。
8.11.6 査察拒否に関する規定
査察拒否とみなされる行為には、FDAが事前アナウンスした査察スケジュールを行うのを施設が拒否する場合や、施設に到着してFDA査察官が査察を行うのを施設が許可しない場合などが含まれる。また、正当な理由なしに適切なスタッフが不在で、FDA査察官が施設を査察することを施設が許可しない場合も査察拒否となる。特に悪質な例として、施設がスタッフを自宅に帰し、FDA査察官に当日は施設では製品を製造していないと伝えるような行為も査察拒否に該当する。
8.11.7 査察の制限に関する規定
査察制限として、施設や製造工程へのアクセス制限、撮影制限、記録へのアクセスやコピーの制限、サンプル収集の制限や妨害などが挙げられる。特に、正当な理由なしに施設がFDA査察の期間中すべての製造の停止を命令する場合や、製造工程の直接観察を不当に制限する場合なども査察制限とみなされる。
これらの規定は、FDA審査の議事録な実施を確保し、製品の品質と安全性を担保するために限り重要である。が求められる。
8.12 査察時の実務的対応と記録管理
8.12.1 サンプル管理の重要性
査察時において、もしFDA査察官がサンプルを持ち帰る場合があった際は、そのサンプルと同じものを必ず企業側でも保持しておく必要がある。この対応は、後日の照合や確認のために極めて重要である。サンプルの持ち帰りの際には、Form 484が発行されることになる。
同様に、ラベルを持ち帰られた場合も、持ち帰られたラベルと同一のものを企業側で保管しておかなければならない。これにより、後日の照合や問題発生時の対応が可能となる。
8.12.2 提供資料の管理
査察官が持ち帰った全ての資料について、その写しを企業側で維持・保管することが必須である。これは単なる記録保持以上の意味を持ち、後日のフォローアップや確認作業において重要な役割を果たす。提供した資料の内容や提供時期を正確に記録しておくことで、後々の対応がスムーズになる。
8.12.3 日次ラップアップミーティングの重要性
毎日のラップアップミーティングの開催を依頼することが強く推奨される。このミーティングには二つの重要な目的がある。一つは、クローズアウトミーティングの際のサプライズを避けることである。もう一つは、査察中に指摘に対する是正を完了またはスタートさせることが可能となることである。
査察中に指摘される事項について、その場で是正を行い、改善を示すことができれば、Form 483を受け取ることになったとしても、annotationのステータスを「是正済み」にしてもらえる可能性がある。このため、日次のラップアップミーティングは極めて重要な機会となる。
8.12.4 宣誓供述書(Affidavit)への対応
FDA査察において、書面への署名を求められた場合には、署名を避けることが賢明である。特に、Affidavit(宣誓供述書)と呼ばれる文書への署名は慎重に検討する必要がある。これは、FDAが不適合等を発見した際に、その内容を認める場合に署名を求められるものである。
署名をしてしまうと、後の行政措置の際に証拠として使用される可能性があるため、署名は避けることが推奨される。この対応は、別に何か問題があるわけではなく、リスク管理の観点から推奨される慎重な対応である。
8.12.5 査察結果への影響要因
査察の結果には様々な要因が影響を及ぼす。まず、GMP、QSRへの適合度合いが基本となる。次に、査察を受けるにあたっての準備と査察期間中の対応が重要となる。さらに、査察官と応対する人、応対の仕方も結果に大きく影響する。
特に注意すべき点として、査察官がどのような人物であるかは蓋を開けてみるまでわからないという事実がある。短い限られた時間で評価を受けることになり、実力を発揮することを妨げる要素もいくつか存在する。そのため、弱い部分をいかにカバーするかという配慮も必要となる。
8.12.6 庶務的事項の重要性
査察官への対応において、庶務的事項(おもてなし)も重要な要素となる。これは単なる接遇以上の意味を持ち、査察全体の円滑な進行に影響を与える要素となる。適切なおもてなしは、コミュニケーションを円滑にし、より建設的な査察の実施につながる可能性がある。

8.13 査察の短期決戦的性質と対応
8.13.1 査察の時間的制約
FDAによる査察は、査察官が米国から日本に来て一度に何社も回るスケジュールが組まれており、一つの企業に費やす時間が限られている。通常4日間または5日間という短い期間での査察となるため、この限られた時間内で査察官を納得させることが極めて重要となる。
8.13.2 効率的な説明の重要性
短い時間で要領よく説明することが求められる。ここでは、簡潔さと論理性、そして綿密さと細やかさが必要不可欠となる。査察官は多忙であり、ゆっくりと話を聞いてもらえる余裕はない。さらに、通訳が間に入ることで、より一層時間的な制約が厳しくなる。
8.13.3 回答の時間的制約
回答が遅い場合や、データがないと判断されることを避けるため、迅速な対応が必要となる。しかし、ここで注意すべき重要な点がある。必要なデータや資料が存在していても、説明の仕方が不適切で査察官を納得させられないことがしばしば発生する。このような事態を避けるためには、事前の準備と練習が不可欠である。
8.13.4 査察実施期間の特徴
FDAの査察は短期決戦である一発勝負の性質を持つ。どれだけ準備をしていても、うまくいかないこともあり、要領よく短い時間で説明するのは非常に難しい。特に以下の点が重要となる:
第一に、論理性があり、きめ細やかで、通訳が訳しやすい回答を心がける必要がある。これは言うほど容易ではなく、実践的な訓練が必要となる。
第二に、査察官は回答をゆっくりと聞いてくれるわけではなく、回答が遅い場合や資料を出せない場合は、即座に「ない」という判断をされてしまう可能性がある。時には「これ以上待ったら指摘を出します」という厳しい言葉を投げかけられることもある。
第三に、質問内容が理解できないまま回答すると、さらなる問題を引き起こす可能性が高い。質問の意図を正確に理解することが極めて重要である。
8.13.5 システム面での準備
当該作業に関係した人全員が正確にSOPを理解しているかどうかが試される。特に、広い責任範囲を有する上位の人は、自分の管轄するSOPを完全に覚えているかどうかが重要となる。署名した人は署名の意味、これは必ず聞かれる事項であり、あなたがこの書面に署名している意味は何かについて、明確に説明できなければならない。
8.13.6 品質システムの実効性
日本の品質システムと違って、FDAの査察では調査というよりも、深い洞察に基づく査察が行われる。そのため、単なる表面的な準備では不十分である。実際の運用実態や、システムの実効性が厳しく問われることになる。
8.13.7 即応体制の整備
練習しておくに越したことはないが、実際の査察では予期せぬ質問や状況が発生することを前提に準備する必要がある。そのため、柔軟な対応力と、迅速な判断力が求められる。これらは組織としての即応体制の整備によって実現される。
査察の短期決戦的性質を理解し、この制約の中で最大限の効果を上げるためには、事前の周到な準備と、実際の査察における冷静な判断力の両方が必要となる。一発勝負という性質上、失敗は許されないという緊張感を持ちながらも、過度に萎縮することなく、自信を持って対応することが求められる。
8.14 査察対応時の重要ポイント
8.14.1 作業関係者の理解度確認
当該作業に関係した人の全員が、正確にSOPを理解しているかが試される。特に、広い責任範囲を有する上位の人は、自分の管轄のSOPを完全に覚えているかどうかが試されることとなる。間違いやあいまいな部分があると、査察官の信頼を損なう可能性が高い。
8.14.2 署名の意味と責任
書類に署名をした人は、その署名の意味する内容について必ず質問される。例えば「あなたがこの書面に署名している意味は何ですか」という質問に対して、明確に説明できなければならない。確認のために署名した場合は確認した事項を、承認のために署名した場合は承認した根拠を説明できる必要がある。実務者を呼んで答えてもらうことができない場合もあるため、事前に十分な練習をしておくことが重要である。
8.14.3 印鑑の管理と運用
日本は印鑑の文化であるが、FDAは印鑑を必ずしも良いとは考えていない。なぜなら、田中さんの判子や山田さんの判子を誰でも押すことができてしまうためである。サインがある場合は本人性が確認できるが、印鑑は必ずしもそうではない。しかし、FDA査察において相手国の文化や法律を批判することは許されていないため、印鑑は認められる。
ただし、印影の管理を適切に行い、印鑑を保管する手順書が必要となる。印鑑を共有の引き出しに入れておくようなことは絶対に避けなければならない。個人の鍵のかかるキャビネットや引き出しに印鑑をしっかりと保管する必要がある。

8.14.4 査察時の確認事項
毎日、ラップミーティングを要請し、内容を確認して何が問題かをきちんと把握しておく必要がある。これにより、指摘を受け入れて改善を示すことができる場合は、翌日にでも実施することが可能となる。翌日でない場合でも、最終日までに伝えるようにすることが望ましい。
指摘を受けた場合は、正面から受け止めるべきではあるが、良いわけではないとして自信を持って回答することも必要である。イクスキューズ(言い訳)はアメリカ人が特に嫌うため、避けるべきである。その代わりに、根拠を持って回答することは適切である。

8.14.5 問題点の把握と対応
指摘された問題点は正確に把握する必要がある。わからない点があれば、その場で確認することが重要である。査察官が当該事象を問題として認識しているかどうかを確認し、指摘された事項が誤解に基づいているのか、事実なのかを確認する必要がある。
日本人は質問をしない傾向があるが、後から「ここがこうだった」と揉めることになるより、その場で直接確認しておくことが望ましい。事実である場合は、謙虚に反省し、SOPの不備等をできるだけ早く改めて実施に移すことが必要である。
8.14.6 査察時の集中と注意点
査察中は、査察官に神経を集中させ、目を離さないようにする必要がある。特にプラントツアーの際には、査察官を一人にすることは避けるべきである。質問に対して迅速かつ的確に回答し、質疑応答事項を記録することも重要である。
良い環境で査察を受けることを心がけ、あえて問題点を議論のテーブルに載せないようにする必要がある。過去に問題があったとしても、ベラベラと喋ることは避けるべきである。査察の質問の意味が理解できないのに答えることも避けなければならず、わからないときは必ず「もう一度言ってください」と確認する必要がある。これは失礼には当たらない。わからない意味で回答することの方が危険である。
査察期間内に必要な資料やデータを提示することも重要である。ただし、データが存在することと、適時に適切に出せることは別問題であることを認識しておく必要がある。特に練習をしておかないと、実際の場面で対応できない可能性が高い。チームワークも重要であり、ドントマインドで互いに励まし合うことが必要である。
これらのポイントは、すべて査察の成否に大きく影響する重要な要素となる。事前の準備と実際の対応の両方において、これらの点に十分な注意を払う必要がある。
8.15 査察時の実践的対応と注意事項
8.15.1 実務的な留意事項
査察期間中は、査察官に神経を集中し、目を離さないようにすることが重要である。質問に対しては迅速かつ的確に回答し、質疑応答事項を記録して、その内容を素早く関係者に知らせる必要がある。良好な環境(静かな部屋)で査察を受け、問題点をあえて議論のテーブルに載せないよう注意する。査察官の質問の意味が理解できず、質問に答えられないことがないよう、しっかりと準備をしておく必要がある。
期間内に必要な資料やデータを提示することも重要である。ただし、「データがある」ということと「質問時にデータを出せる」ということは別であることを認識しておく必要がある。質問に対して「的確に回答し、的確な資料を出す」ことは、言うほど簡単ではない。よく整理し、練習しておくことが必要である。
8.15.2 チームワークと連携の重要性
手違いが発生すると、すぐに実力以下の力しか発揮できなくなる。多くの人が関係するため、手違いが起きやすいことも忘れてはならない。手違いをなくすためには、査察に関与する人のチームワークが必要である。自分たちのやっていることをしっかり把握しておくことが大切である。
データや資料の問題の有無をあらかじめ把握し、場面ごとにどのデータや資料で説明するのが有利かを判断することが必要である。少しでも都合よく進めるためには、どのデータ、資料が有利かを常に考えながら進める必要がある。何が都合がよいかを含めて関係者でよく協議しながら進めることが重要である。
8.15.3 スタッフの対応と準備
スタッフ全員が回答できるようにしておく必要がある。現場ツアーの際に現場に居合わせる可能性のあるスタッフには、「作業内容についての復習」と「質問に答える練習(たとえば、この工程の工程パラメータを説明してください)」をして本番に備える。候補者を数人あげておき、周りの人がさりげなくサポートする体制を整えることが重要である。
手違いが起こりやすい例として、査察官の質問を誤解する、間違った資料が出てくる、Q&Aを作成したのに別の答えをしてしまう、社内の人間関係が悪いなどが挙げられる。査察のときくらいは一丸となって対応することが望ましい。査察官の質問や指摘を受けてしまうと足並みが乱れてガタガタになってしまうため、一つ二つの指摘なのは大したことないと元気付けるようなとりまとめる人が必要である。
8.15.4 昼休みと事後ミーティングの活用
昼休みや査察官が帰った後には、ぜひミーティングを開催し、反省会を行い、翌日の対応を考え、協議をする。その際は事実関係に基づいて協議をすることが極めて重要である。
8.15.5 査察官への説明における留意点
査察官への説明については、説明をして初めて納得をしてもらえる場合と、説明をしなくてもわかってもらえる場合がある。説明をしたからといってわかってもらえるという保証はない。これは難しい課題である。そのため、特別な説明ができるだけ少なくて済むようなシステムを作ることが必要である。
その準備として、セカンドスクリーンに補助用の英語の資料を作成しておくことが効果的である。規制要件に沿ったフローチャートを書いておくことも有用である。このような準備は非常に効果的である。
8.15.6 インタビューへの準備
全員がインタビューを受ける準備をしておくことが重要である。資料の提供に関しては、コンフィデンシャルの印を押して渡し、控えをとることを忘れないようにする必要がある。これは査察時に生じた科学的・技術的問題について、後日FDAと協議する際に必要な書類となる可能性があるためである。
8.15.7 査察をいかに有利に進めるか
査察に完璧な準備というものは実質的にありえず、どこかに弱い点が存在するものである。その弱い点をカバーする努力をできるだけ行うよう気を配ることが重要である。チャンスがあれば、できるだけこちらの都合のよいように進めるよう気を配る必要がある。全体の流れ・動きを把握して少しでも有利になるよう判断しながら進めていく必要がある。これには判断できる人の存在が必要である。
査察官の言いなりに動くのではなく、場面によってはこちらがリードできる場合もある。特に重要な点として、提示する資料を査察を受ける側が選べる場合がある。査察の準備の段階で、問題の少ない順(自信のある順)に資料を整理しておき、良いものから提示することが可能な場合もある。
8.15.8 回答の仕方と留意点
回答においては、常に正直に答えることが基本である。質問全体の意味が分かるまでは答えないことが重要であり、もし査察官の質問が完全に理解できなかった場合は、「質問を繰り返していただけますか」と依頼する。訊かれたことにだけ答え、余計な情報は提供しない。可能である時はYes/Noで答えることを心がける。
自分の責任範囲外の質問には答えないことも重要である。質問の答えを知らない場合は、知らない旨を伝え、推測で答えることは避ける。はっきり、ゆっくり、適切な声の大きさで話すことを心がけ、間の取り方にも気を付ける必要がある。
特に注意すべき点として、2度同じことを訊かれた場合は要注意である。これは指摘をする前の確認である可能性が高い。要求されていない文書を査察場所に持ち込まないことも重要である。
8.15.9 うまく回答できない原因とその対策
回答が上手くいかない原因としては、以下のような状況が考えられる:
まず、回答に相当するデータあるいは資料がない場合がある。また、回答者が質問内容を理解できない、あるいは誤解する場合もある。回答者がデータのあることを知らない、あるいはデータのあることを知っていても内容を理解していないというケースも多い。さらに、通訳者が正しく通訳できないという問題も発生しうる。
このような問題を防ぐため、苦し紛れに答えることは避けるべきである。その代わりに、「正確な回答を期するために関係者で相談させてください」と言うことができる。ただし、これは毎回は使えず、1回2回程度に限定すべきである。このように対応することで、ちゃんと答えようとしてくれているというイメージを与えることができる。また、すぐに「知らない、ありません」と言わず、回答できる人を連れてくることも重要である。
8.15.10 査察時に行ってはいけないこと
査察において避けるべき行為として、以下のような点に注意が必要である:
人によって言うことが異なることは絶対に避けなければならない。例えば、居室での質疑応答とツアー中に作業者が答える内容が異なるような状況は望ましくない。また、不当な防御策を講じることも避けるべきである。FDAは敵ではなく、またFDAを敵にする必要もない。FDAに対して拒絶反応を示したり、査察に対し不当な防御策を講じたりすることは適切ではない。
苦し紛れに答えることも避けるべきである。同席している製造所長や部長の前で「わかりません」とは答えにくく、つい無理な答えをしてしまう傾向があるが、これは避けなければならない。また、回答者がしゃべりすぎることも問題となる。査察官の質問に対して、聞かれてもいないことを答えたり、追加質問に対してさらに余計なことを答えたりするような悪循環は避けるべきである。
8.15.11 コミュニケーション上の注意点
長々とした説明や、通訳が理解できない説明、間違った説明は避けるべきである。Yes/Noの質問にはYes/Noで答えることを基本とし、自発的に情報を提供することは控えるべきである。「どんどん東武などは」という表現に代表されるように、ドアを開けたら査察官が入ってくるような状況は避けるべきである。
想像で答えることは絶対に避けなければならない。誤解を招くような情報や間違った情報を与えることも厳禁である。また、査察官と対立することも避けるべきである。かつて、ある企業の社長が査察官と議論を始めてしまい、準備が台無しになったという事例もある。
8.15.12 査察官への対応とおもてなし
査察官はVIPとして扱い、快適に過ごしていただくためのおもてなしが必要である。食事に関するアレルギーやベジタリアンといった制限の有無を確認し、ホテルの環境にも配慮する必要がある。女性の査察官の場合は、女性用化粧室の準備など、特別な配慮も必要となる。
ホテルの手配、当日の送迎の手配、昼食の手配など、細かな点にも注意を払う必要がある。空港や駅への送迎も重要であり、できれば前日に査察官と接触して夕食を共にし、人となりを見ておくことが望ましい。
8.16 クロージング対応
査察の最終段階では、指摘事項への適切な対応が重要となる。Form 483が発行された場合、15営業日以内にレスポンスを提出する必要があるが、最初のレスポンスは詳細である必要はない。まずはラフな改善計画を提出し、その後詳細な対応を段階的に示していく方法が推奨される。
特に注意すべき点として、実現不可能な改善約束をしないことが重要である。次回の査察で約束が守られていないことが判明すると、より深刻な指摘につながる可能性がある。また、レスポンスは査察を実施した査察官ではなく、FDA本部に送付する必要がある。
8.17 結論
FDA査察への対応は、事前の周到な準備と当日の適切な実施の両方が不可欠である。すべての関係者が自身の役割を十分に理解し、チームとして協力することで、効果的な査察対応が可能となる。特に文書管理、コミュニケーション体制、人員配置については、細部まで配慮した準備が必要である。また、予期せぬ状況にも柔軟に対応できる体制を整えておくことが、成功的な査察対応の鍵となる。