第3章 FDAの組織と査察
FDAは米国保健福祉省(Department of Health and Human Services: DHHS)に属する連邦政府機関の一つであり、1906年に創設された。その主たる業務は、医薬品、化粧品、食品等の品質、有効性、安全性を保証し、米国民の健康と生活環境の維持・増進を図ることである。
FDAには所管分野ごとに6つの主要なセンターが設置されている。その中核となるのがCDER(Center for Drug Evaluation and Research:医薬品評価研究センター)であり、医薬品の評価と研究を担当している。また、生物製剤の評価と研究を担当するCBER(Center for Biologics Evaluation and Research)、医療機器と放射線機器を管轄するCDRH(Center for Devices and Radiological Health)が設置されている。さらに、食品安全と応用栄養を担当するCFSAN(Center for Food Safety and Applied Nutrition)、動物用医薬品を担当するCVM(Center for Veterinary Medicine)、そしてタバコ製品を管轄するCTP(Center for Tobacco Products)が存在する。
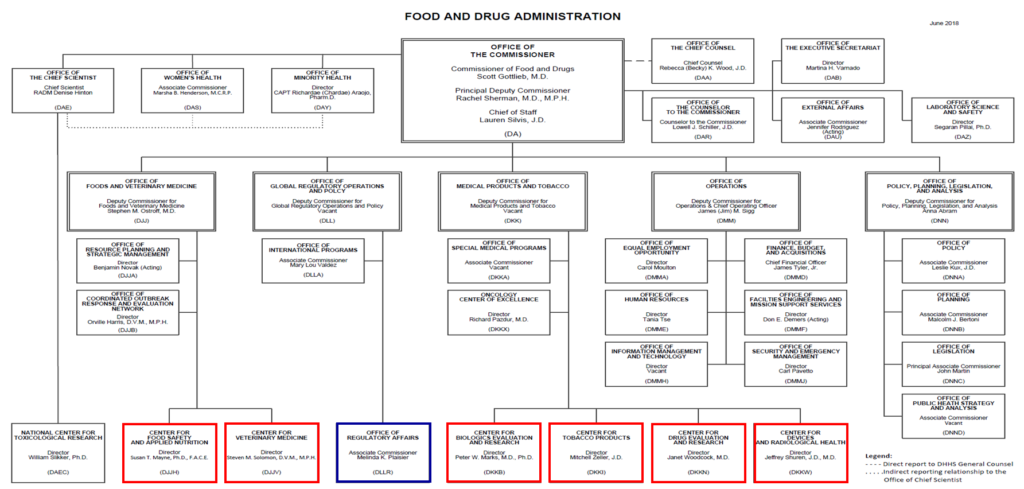
特筆すべき点として、CDERとCBERは元来、CDB(Center for Drugs and Biologics)という一つの組織であった。しかし、科学技術の進展に伴う審査資料内容の増大やAIDS問題への対応、その他医薬品・生物製剤評価に関する諸問題に取り組むため、1987年10月に2つの組織に分割された。この分割により、化学合成医薬品は後発医薬品や一般用医薬品も含めてCDERの管轄となり、一方で生物学的製剤はCBERの管轄という明確な業務の棲み分けがなされた。
CDERは6つのセンターの中で最大規模を誇り、約1,800人の職員を擁する巨大組織である。これほどの規模に至った背景として、1992年に制定されたPDUFA(Prescription Drug User Fee Act:医療用医薬品使用料法)と、それを改訂した1997年のPDUFAⅡの存在がある。これらの法整備により、その規模は急激に拡大している。今後もGCP査察の強化や審査の一層の迅速化を目指し、職員の増員が継続される予定である。このような人員の増大や医療環境の変化、法制度の改変等に呼応して、CDERの内部組織はしばしば変更されている。
CDERの組織構造は、官房にあたるOffice of the Center Directorを頂点として、IND(Investigational New Drug)やNDA(New Drug Application)の審査を行うOffice of Review ManagementとOffice of Pharmaceutical Scienceの2つの主要なOfficeから構成されている。
Office of Review Managementには、審査部門としてOffice of Drug Evaluation I~Vが設置されており、その下には薬効群ごとに14の新薬担当DivisionとOTC担当Divisionが配置されている。また統計的サポートを行うOffice of Biostatisticsも設置されており、さらに近年の市販後回収が続いたことを受けて、Office of Post Marketing Drug Risk Assessmentが新設された。
Office of Pharmaceutical Scienceには、審査に関連する複数の重要な組織が設置されている。規格と微生物学を担当するOffice of New Drug Chemistry、臨床薬理と薬物動態を担当するOffice of Clinical Pharmacology and Biopharmaceutics、後発品審査を担当するOffice of Generic Drugs、そしてレギュラトリーサイエンス研究部門であるOffice of Testing and Researchである。
上記2つの主要なOffice以外にも、Office of the Center Directorに直属の組織として、GCP査察やGMP査察等の運営、措置決定を行うOffice of Compliance、市販後の広告・宣伝活動の監視、指導を行うOffice of Medical Policy等が設置されている。これにより、CDER全体で、治験段階から承認審査、市販後に至るまで、医薬品の包括的な保証体制を構築している。
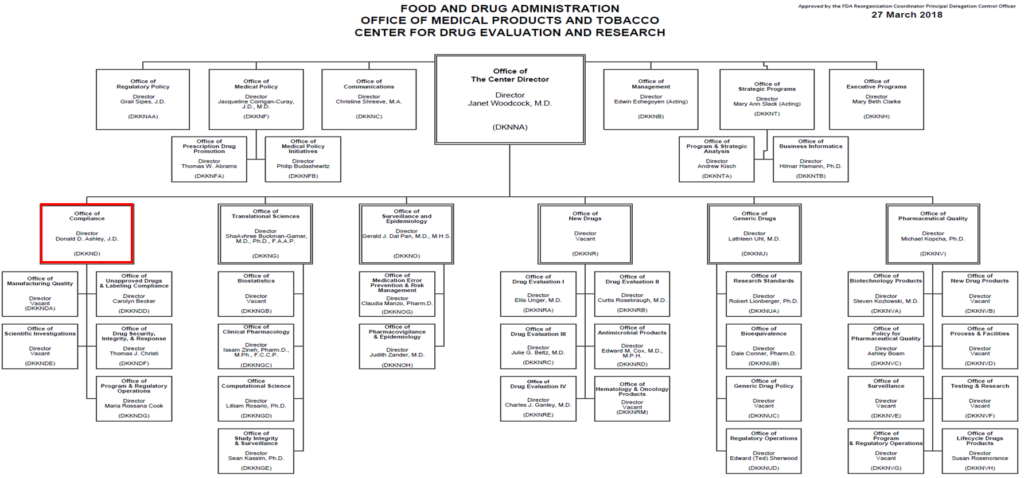
ORA(Office of Regulatory Affairs)は、世界各国のGMP査察を行っており、さらに水際では税関での抜き取り調査も実施している。また、法廷の差し止め命令、押収・没収、禁輸措置といった強力な権限が与えられている。実際の査察業務は、ORAが全米29カ所に持つ地方事務所を通じて実施されており、これは日本でいえば都道府県の薬務課に相当する組織である。日本への査察官の派遣も、これらの地方事務所から行われ、その中心となっているのはOffice of Complianceという部門である。
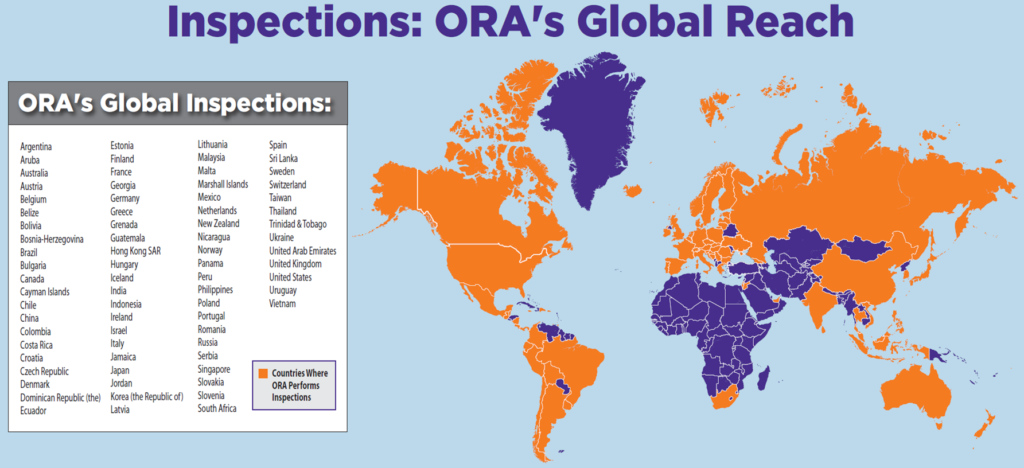

FDA Investigatorの多くは、Life Science関連の学位を持っており、一部には業界出身者も存在する。全てのInvestigatorは査察官としての専門的な教育・訓練を受けており、特にデータの改ざんを発見する手法や不正を発見する手法、データインテグリティ査察の方法など、専門的なトレーニングを受けている者が多い。これにより、高い専門性と実務能力を備えた査察の実施が可能となっている。