FDA医療機器規制の歴史

1978年7月21日、FDAは連邦官報(43 FR 31508)で最終規則を発行し、FD&C法のセクション520(f)に基づく医療機器のcGMP要求事項(医療機器GMP)を確立した。
当該規則は1978年12月18日に発効し、Part 820の下で成文化された。
医療機器GMPがQSRに変更になった訳
GMPとはGood Manufacturing Practiceの略であり、実践製造規範である。
医薬品の場合は、回収事案のほとんどが製造品質に起因する。ところが、医療機器の場合は、たとえ図面の通り適切に製造したとしても、そもそも設計が間違っていたとすれば、安全な医療機器にはならないのである。
つまり、医療機器の安全性確保のためには、適切な設計管理が必要である訳だ。
医療機器安全法(SMDA)
1978年7月21日に公示されたGMP規則は医療機器の製造および品質管理に対する要件を定めているが、1990年に「医療機器安全法」(Safe Medical Device Act / SMDA)が成立するまではほとんど変更がなかった。
SMDAは、機器の回収のうちのかなりの割合が、製品設計の欠陥に起因するという発見に基づいて法律が変更された訳である。
SMDAはGMP規則に設計管理(Design Control)の要件を盛り込むことや外国とのGMP相互認証協定への努力を求めた。
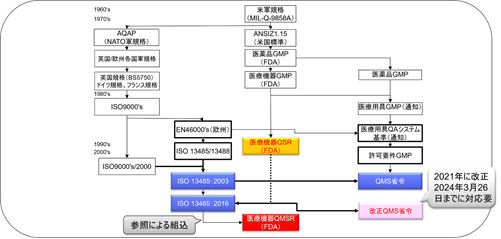
SMDAにより、FDAは設計管理をcGMP規制に追加する権限を得たのである。 FDAは、SMDAのもとにGMP規則を改正して新しく設計管理規定を加え、同時にGMP規則をできる限り国際基準(ISO9001)に含まれる品質システムの要件に合わせる方針をとった。
医療機器GMPからQSRへ
GMP規則改正の動きは、1990年4月の医療機器GMP諮問委員会の開催から始まった。
この年から1995年にかけて、規則立案の事前公示(Advance Notice of Proposed Rulemaking)、一般からコメントを求める規則案の公示、GMP作業原案(Working Draft)の利用と原案に対するコメントを求める公示、GMP公聴会の開催、GMP諮問委員会の開催など、規則改正に向かって各種の手順が進むとともに、機器回収データの分析や国際品質基準などの評価が加わることによって、FDAは医療機器GMP改正を決断した。
SMDAによる変更を実装するために、FDAは1996年にPart 820を改定し、現行の品質システム規則(QSR:Quality System Regulation)を制定した。
医療機器GMP規則は、多くの異なるタイプの医療機器に適用しなければならないことから特定の機器に対する製造要件を詳しく規定することよりは、むしろすべての製造業者が守らなければならない大枠を定める方が合理的であると判断した。
その趣旨にしたがってFDAは、製造業者の品質要件の達成に柔軟性を与えるため、規則案と作業班原案に変更を加えて最終GMP規則として、1996年10月7日、「品質システム」(QS:Quality System)と呼ぶ新しい規則を公示した。
QSRは、ISO 13485:1996/ISO 9001:1994を基礎にして作成された。
QSRは、医療機器の設計、購入、製造、包装、表示、保管、設置およびサービスで用いられる手順とこれらに対して用いられる設備および管理に関する要件を含む。
QSR制定当時から、FDAはcGMP規制を、その時点で適用される国際規格に含まれる品質管理システムの要求事項と可能な限り調和させることを目指していた。
FDAはGHTFおよびISO技術委員会210(TC 210)と緊密に協力した。
QSRは、医療機器の設計、購入、製造、包装、表示、保管、設置およびサービスで用いられる手順とこれらに対して用いられる設備および管理に関する要件を含む。
規則の定義では、品質(Quality)は安全性や性能を含めて使用適合性(Fitness-for-use)を満たすため機器の能力を支える特徴(Feature)と特質(Characteristic)の総体をいい、QS(Quality System)は品質管理の実施に対する組織構造、責任、手順、プロセスおよび資源をいう。
QSRからQMSRへ
2022年2月23日、FDAはQSRをISO 13485:2016に整合させる改正案を公表した。
QSRをISO 13485:2016と整合させる規制は「Quality Management System Regulations / QMSR」(品質マネジメントシステム規制)と呼ばれる。
QMSRはISO 13485:2016の要求事項を組み込むことにより、ISO 13485:2016と多くの要求を整合させる予定となっている。
その一方で、苦情ファイル等の記録の保持に関してISO 13485:2016に追加的要求事項を上乗せしている。
現在、FDAは、QMSRを2023年12月頃までに最終化する予定である。 経過措置期間については様々な意見があり、未決定の模様だ。


