品質リスクマネジメントについて

GMP施行通知の施行(2013年8月30日)から5年が経過し、2019年度にはGMP省令が改正されることになった。
今回の改正は大改正となる。いわゆるグローバリゼーション化(規制の国際整合)が目的であろう。
その中において、品質リスクマネジメント(ICH-Q9)への適格な対応も求められることとなる。
これまでICH-Q9 「品質リスクマネジメントに関するガイドライン」は課長通知として発出されてきた。
しかし、改正GMP省令においては、適切に品質リスクマネジメントが活用されるよう、ICHQ9の原則に則して手順書の作成と実施が求められる。
しかしである。日本の製薬企業で品質リスクマネジメントについて正しく理解している企業はどれくらいあるだろうか。
PMDAのホームページには、以下のような概念図が示されている。
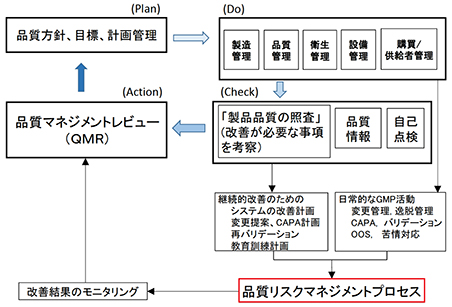
品質リスクマネジメントがあたかもPDCAによる改善プロセスの一部のように解説されている。
これは明らかに間違いである。
品質リスクマネジメントプロセスもPDCAサイクルを持っており、品質管理・品質保証と並行して実施されなければならない。
また品質リスクマネジメントの手順書サンプルも公開されている。これも間違いである。
そもそも、品質リスクマネジメントは、特定の部署が特定の手順書を参照して活動するものではないのである。
すべてのプロセスにおいて、現存する手順書にリスクマネジメントの概念を入れ込まなければならない。
つまり品質リスクマネジメントに特化した部署を設ける訳ではないし、品質リスクマネジメントに特化したSOPを作成するのでもないのである。
ちなみに上記の図において、品質マネジメントレビュは(ISO-9001では)ActionではなくPlanである。
ActionにはCAPA等の改善プロセスが位置しなければならない。
FDAは2006年9月に、国際規格である品質マネジメント規格のISO-9001を参考にした「医薬品cGMPにおける品質システムからのアプローチ(Quality Systems Approach to Pharmaceutical CGMP Regulations)と題するガイダンスを発行している。
グローバリゼーションが避けて通れないなか、日本の規制要件においても、国際規格、FDA、PIC/S等の真の要求事項の理解と適切なプロセス構築が望まれる。
データインテグリティに関する規程・手順書
イーコンプレスでは「データインテグリティ規程・手順書」の販売を開始いたしました。
データインテグリティ規程・手順書 55,000円(税込)
【目次】
データインテグリティ規程
1. 目的
2. 適用範囲
3. 用語の定義
4. 背景
5. データインテグリティの原則
6. データガバナンス
6.1 データインテグリティのためのステップ
6.1.1 教育およびコミュニケーション
6.1.2 リスクの発見および低減
6.1.3 技術およびITシステム
6.1.4 データガバナンス
7. 手順書等
8. 参考
9. 付則
データインテグリティ手順書
1. 目的
2. 適用範囲
3. 用語の定義
4. 役割と責任
5. 啓発活動
6. 教育訓練
7. 関連する手順書の改訂
7.1 リスクマネジメント
7.1.1 リスクの検討
7.1.2 リスク低減策の検討
7.1.3 リスク低減策の実施
7.2 データライフサイクル
7.2.1 データの作成
7.2.2 データの処理
7.2.3 データのレビュ・報告・使用
7.2.4 データの保管・維持
8. コンピュータシステムの見直し、導入
9. 監視・測定
10. 監視・測定
11. 記録の保管
12. 参考
13. 付則
ご購入は こちら





