EDCをはじめよう
EDCについて研究するページです。
*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
2008年10月20日に(財)日本薬剤師研修センター主催で開催された「平成20年度 GCP研修会」で、医薬品医療機器総合機構(以下、機構)信頼性保証部からEDCに関する信頼性調査(書面調査)の概要が発表された。
ER/ES指針が発出されて3年半が経つが、いよいよ本格的なER/ES査察が開始されることになる。
発表された信頼性調査チェックリストは、まだ改定と公式な発表が必要であると思われる。しかしながら、準備は早急にしておかなければならない。なぜならば、現在実施中の治験における電子記録は、間違いなく書面調査の対象となるからである。
これまで書面調査は、機構に原本を搬入して行われていた。しかしながら、EDCシステムのように原本が電子の場合、機構会議室では確認ができない事例が発生している。このため、原本を確認するために、必要に応じて、依頼者側に訪問(訪問型書面調査)の上実施されることになる。
しかしながら現行のEDCシステムの一般的な運用方法と、規制当局の認識には、多少のずれがあるように思われる。
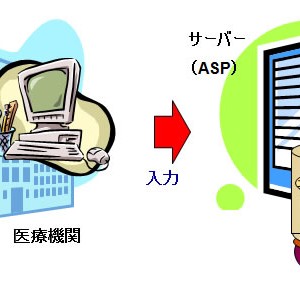
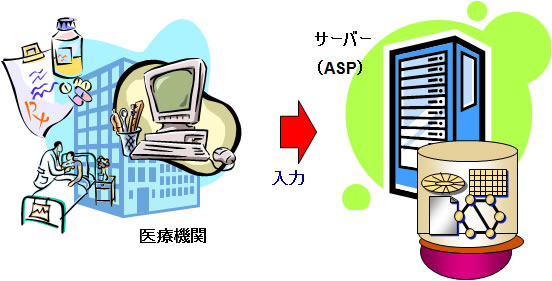
これまで製薬会社は、臨床試験において「紙」の症例報告書(以下、紙CRF)を用いて症例データを取得していましたが、最近では電子的にデータを取得するElectronic Data Captureシステム(以下、EDC)が注目されるようになってきました。
症例報告書を電子化できる根拠としては「厚生労働省の所管する法令の規定に基づく民間事業者等が行う書面の保存等における情報通信の技術の利用に関する省令」(厚生労働省令第44号 平成17年3月25日)があげられます。
日本においては、EDCはその利用が始まったばかりでです。製薬企業にとっても、規制当局にとっても経験の蓄積がありません。
日本国内でのEDCに関する体制・制度が十分に整備されていない現状において、EDCを推進することは、製薬企業および規制当局にとって大きなリスクがあるといえます。
規制当局は、紙CRFを廃止し、電子CRFを原本にした場合、EDCを利用した試験成績が受入れ可能か不明であると述べています。
しかしながら、グローバルではEDCの利用が一般的となり、日本が組み込まれたグローバル治験においてもEDCを利用する機会が増大しています。
日本だけがEDC利用を躊躇しているわけにはいかない状況です。
製薬企業は、EDCの安易な運用により今後のEDC推進に悪影響を及ぼさないように、慎重に経験を積んで進めていかなければなりません。
【第1話】EDCとは
【第2話】EDCのメリット
【第3話】EDCのリスク
【第4話】電子化におけるリスク
【第5話】規制当局の懸念とは
【第6話】EDCの導入、運用フロー概要
【第7話】ベンダーオーディットをしよう
【第8話】こんなベンダーは使ってはいけない
【第9話】こんなEDCは使ってはいけない
【第10話】こんなCROは使ってはいけない
【第11話】プロトコールを作成しよう[準備中]
【第12話】データマネージメント計画書を作成しよう[準備中]
【第13話】契約書を作成しよう[準備中]
【第14話】手順書を作成しよう
【第15話】UQSを実施しよう[準備中]
【第16話】CSVを実施しよう[準備中]
【第17話】関連法令
【第18話】臨床試験データの電子的取得に関するガイダンスとは
【第19話】査察対応
【番外編】FDAのガイダンス EMEAのガイダンス